
| ���� | ��ƷA | T1oC�µõ�����X | T2oC�µõ�����Y | 600oCʱ�õ�����Z |
| ����/g | 13.92 | 11.75 | 7.45 | 6.36 |


 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��44.8 L | B��22.4 L | C��11.2 L | D��5.6 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����״���£�22.4L�ױ��У�����C��H����ĿΪ8 NA |
| B��t��ʱ��MgCO3��Ksp=4��10-6������Һ�к�Mg2+��ĿΪ2��10-3 NA |
| C���ڷ�Ӧ4FeS2+11O2=2Fe2O3+8SO2�У�ÿ����1molSO2ת�Ƶ�����Ϊ5.5 NA |
| D��50g46%���Ҵ�ˮ��Һ�У�����ԭ������ĿΪ3 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
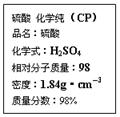
| A������200 mL 4.6 mol/L��ϡ������ȡ������50 mL |
| B��1 mol Zn�������ĸ����ᷴӦ����2 g H2 |
| C��������������������������� |
| D������С�Ľ������ὦ��Ƥ���ϣ�Ӧ������NaOH��Һ��ϴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | Mg2+ | Al 3+ | ������ | Al(OH)3 |
| ��ʼ����pH | 8.93 | 3.56 | ��ʼ�ܽ�pH | 8.04 |
| ��ȫ����pH | 10.92 | 4.89 | ��ȫ�ܽ�pH | 12.04 |






�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������0.90mol | B����0.45mol |
| C������0.45mol | D����0.45mol��0.90mol֮�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com