
以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
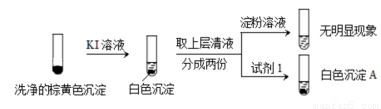
2 mL | 0.2 mol·L?1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L?1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L?1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42?,含有Cu+、Cu2+和SO32?。
已知:Cu+ Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+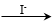 CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32?。
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32?的理由是_______________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42?,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和____________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i. Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
将对比实验方案补充完整。
步骤一:
步骤二:

则V1___________V2(填>,<或=)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
科目:高中化学 来源: 题型:选择题
| A. | 0.067mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:填空题
镍(28Ni)金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为_____________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:__________、_____________、___________。
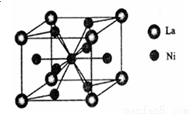
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示.则该晶体的化学式为_________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式__________。
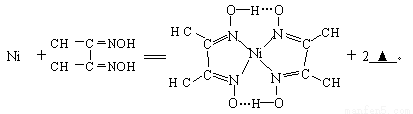
与Ni2+配位的N原子有_________个,该配合物中存在的化学键有__________(填序号)。
A共价键 B离子键 C配位键 D金属键 E氢键
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:选择题
燃料电池具有能量转化率高无污染等特点,如图为Mg—NaClO燃料电池结构示意图。下列说法正确的是( )

A.镁作Y电极
B.电池工作时Na+向负极移动
C.废液的pH大于NaClO溶液的pH
D.X电极上发生的反应为:ClO-+2H2O-4e-=ClO3-+4H+
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O 2 CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2 CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
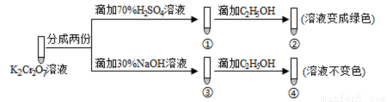
结合实验,下列说法正确的是
A.①中溶液变黄,③中溶液橙色加深
B.②中Cr2O72-被C2H5OH氧化
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.1 molN2与4 mol H2反应生成的NH3分子数为2NA
B.2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA
C.标准状况下,2.24L的CCl4中含有的C—Cl键数为0.4NA
D.标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
镁铝合金5.1 g溶于300 mL 2 mol·L-1的盐酸中,在标准状况下放出气体的体积为5.6 L。向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
A.5.1 g B.10.2 g C.13.6 g D.15.3 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com