
短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
(1)第三周期Ⅳ族(1分) 离子键(1分)
(2)2Al+2OH?+2H2O = 2AlO2-+3H2↑ (2分)
(3)C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ?H=" -" 28a kJ?mol-1 (2分)
(4)SiCl4+3H2O =H2SiO3↓4HCl↑ (或SiCl4+4H2O 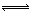 H4SiO4↓+4HCl↑)可以不标“↑”“↓”(2分)
H4SiO4↓+4HCl↑)可以不标“↑”“↓”(2分)
(5)0.25mol?L?1 (2分)
解析试题分析:A的原子半径最小,则A为H元素;X原子最外层电子数是次外层的两倍,则X为C元素;D是短周期中金属性最强的元素,则D为Na元素;E的最高价氧化物对应水化物是一种常见的两性氢氧化物,则E为Al元素;R与X同主族,则R为Si元素;T的负一价阴离子的核外电子排布与Ar原子相同,则T为Cl元素。
(1)R为Si元素,在元素周期表中位于第三周期Ⅳ族;化合物DT为NaCl,含有离子键。
(2)E为Al,与NaOH溶液反应的离子方程式为:2Al+2OH?+2H2O = 2AlO2-+3H2↑
(3)X2A4 为C2H4,1g C2H4完全燃烧,恢复到常温时放出a kJ的热量,则1mol C2H4即28g完全燃烧,恢复到常温时放出28a kJ的热量,可得热化学方程式:C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ?H=" -" 28a kJ?mol-1
(4)RT4为SiCl4,水解生成的两种酸为H2SiO3和HCl,或H4SiO4和HCl,所以水解方程式为:SiCl4+3H2O =H2SiO3↓4HCl↑ (或SiCl4+4H2O 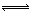 H4SiO4↓+4HCl↑)
H4SiO4↓+4HCl↑)
(5)该酸的pH=4,则该酸电离出的H+浓度为10-4mol?L?1,设该酸的物质的量浓度为C,根据电离平衡常数可得:Ka =10-4×10-4÷(c-10-4)= 4.0×10-8,解得c=0.25mol?L?1
考点:本题考查元素的推断、方程式的书写、化学键的判断、电离平衡常数的计算。


科目:高中化学 来源: 题型:填空题
X、Y、Z、W四种短周期元素在元素周期表的位置如图。其中W的原子序数是Y的2倍。
(1)W离子的结构示意图为____________。
(2)X的最简单氢化物与Cl2发生取代反应的化学方程式为(写一个)________________。
(3)能证明X、Z两元素非金属性强弱的离子方程式为__________________________。
(4)一定条件下,在密闭容器中,充入一定量的XY2(g)和XY (g),发生反应:
WY2(g)+2XY(g) 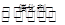 2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:
2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:
②若温度升高到T2oC时,反应的平衡常数为6.64,则该反应的正反应为_______反应(填 “吸热”或“放热”)。
(5)① 25℃、101 kPa,l mol金属镁完全燃烧放出300.0 kJ热量,1 mol单质X完全燃烧放出393.5 kJ热量。金属镁与X的最高价氧化物反应的热化学方程式为_________。
②室温下,Mg(OH) 2饱和溶液_________(填“能”或“不能”)使酚酞试液变红,通过计算说明原因(已知:Ksp[Mg(OH) 2]=4.0×10-12)。答__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.X、W、Y、Z均为短周期主族元素,原子序数依次增大,X原子的最外层电子数是W的4倍,X、Y在周期表中相对位置如下图。
| X | | |
| | | Y |
 8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。
8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。 zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为________。
②NO3—的空间构型是________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为________。
②H2O分子中O原子轨道的杂化类型为________。
③1 mol CO2中含有的σ键数目为________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E为五种原子序数依次增大的短周期主族元素。已知B的最外层电子数与核外电子总数之比为3∶4;D的最外层电子数与次外层电子数之比为3∶4,E-、C+、A+的半径逐渐减小;常温下化合物AE为气体。
请回答下列问题:
(1)D、E的最高价氧化物对应水化物酸性较强的是________(写化学式)。
(2)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2 mol电子通过时两极产生的气体在标准状况下的体积共________ L。
(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:_______________________________。
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,乙溶液中水的电离程度比纯水的小。则化合物乙中的化学键类型为________;若丙为常见家用消毒剂的主要成分,则丙的化学式是________。
(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是______________________________________________;其中一种是强酸对应的酸式盐,写出向Ba(OH)2溶液中逐滴加入该盐溶液至中性发生反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表列出了A~R十种元素在周期表中的位置:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | | | | E | R | F | |
| 3 | A | C | D | H | | I | G |
| 4 | B | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1) Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
(3)X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧热的热化学方程式:
_____________________________________________________________________。
(4)ZX的电子式为______;ZX与水反应放出气体的化学方程式为_____ ________。
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2  Fe + 2ZG
Fe + 2ZG
放电时,电池的正极反应式为_________________________:
充电时,______________(写物质名称)电极接电源的负极;
该电池的电解质为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L。W的原子最外层电子数与核外电子总数之比为3∶8,X的原子序数是Z的原子序数的一半。
(1)Z的原子结构示意图为 ,W与P可形成原子个数比为1∶2的化合物,其电子式为 。
(2)经测定,在2.5×1.01×105 Pa下,Y 与P形成的化合物的熔点为190℃,沸点为180℃,则该化合物为 晶体。
(3)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是 (填化学式)。
(4)Y与W形成的化合物遇水分解,发生反应的化学方程式为 。
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色。该反应的化学方程式为 ,若0.6mol X的三氟化物完全反应,则转移的电子总数约为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a | | | |||||||||||||||
| b | | | | c | d | e | f | | |||||||||
| g | h | i | j | | k | l | m | ||||||||||
| n | | | | | | | o | | | | | | | | | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com