
| A. | 电解水:2H20=2H2↑+O2↑ | B. | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||
| C. | 2F2+H2O=4HF+O2 | D. | 3NO2+H2O=2HNO3+NO |
分析 反应Br2+SO2+2H2O=H2SO4+2HBr中,水中的H、O元素没有变价,所以水既不是氧化剂也不是还原剂,据此分析.
解答 解:A、电解水:2H20=2H2↑+O2↑中水既是氧化剂又是还原剂,与Br2+SO2+2H2O=H2SO4+2HBr中水的作用不相同,故A错误;
B、4Fe(OH)2+O2+2H2O=4Fe(OH)3中水既不是氧化剂也不是还原剂,与Br2+SO2+2H2O=H2SO4+2HBr中水的作用相同,故B正确;
C、2F2+H2O=4HF+O2中水是还原剂,与Br2+SO2+2H2O=H2SO4+2HBr中水的作用不相同,故C错误;
D、3NO2+H2O=2HNO3+NO中水既不是氧化剂也不是还原剂,与Br2+SO2+2H2O=H2SO4+2HBr中水的作用相同,故D正确.
故选BD.
点评 本题考查学生氧化还原反应中的基本概念知识,注意根据元素的化合价的变化进行回答,难度不大.


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 | 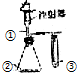 |
| A | 稀盐酸 | Na2SO4 | 溴水 | SO2具有漂白性 | |
| B | 浓氨水 | CaO | AlCl3溶液 | 白色沉淀生成后又溶解 | |
| C | 双氧水 | MnO2 | KI溶液 | 氧化性:O2>I2 | |
| D | 稀醋酸 | Na2CO3 | Na2SiO3溶液 | 酸性:醋酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,结构式是F-O-O-O-F.
,结构式是F-O-O-O-F.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:| X | Y | Z | |
| W | M | Q |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.
;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 元素的金属性:Mg>Al | ||
| C. | 酸性:HClO4>H2SO4 | D. | 相对分子质量:Ar>K |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
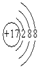

 ,化合物中含有离子键键(填离子或共价)
,化合物中含有离子键键(填离子或共价)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com