
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
【答案】D
【解析】分析:本题考查反应速率和平衡的基本知识。根据题目的反应,主要判断外界条件的变化对平衡和速率的应该结果即可。
详解:A.加入NaOH,中和HBr,平衡逆向移动,可增大乙醇的物质的量。选项A正确。
B.增大HBr浓度,平衡正向移动,有利于生成C2H5Br。选B正确。
C.若反应物增大至2 mol,实际上就是将反应的浓度都增大至原来的2倍,比例不变(两次实验反应物的比例都是1:1,等于方程式中的系数比),这里有一个可以直接使用的结论:只要反应物的投料比等于系数比,达平衡时反应物的转化率一定是相等的。所以两种反应物的转化率一定是1:1。选项C正确。
D.若起始温度提高至60℃,考虑到HBr是挥发性酸,在此温度下会挥发出去,降低HBr的浓度减慢速率,增加了反应时间。选项D错误。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
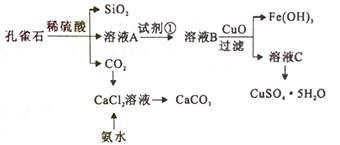
下列说法正确的是
A. 为将溶液A中的Fe2+氧化为Fe3+,试剂①可选用双氧水、氯气等
B. 流程中所加的CuO可以用Cu代替
C. 由溶液C获得CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤等操作
D. 制备CaCO3时,应向CaCl2溶液中先通入CO2,再加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:

①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A. 阴极的电极反应:CO2+2H++2e-=CO+H2O
B. 协同转化总反应:CO2+H2S=CO+H2O+S
C. 石墨烯上的电势比ZnO@石墨烯上的低
D. 若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①固体烧碱 ②HCl气体 ③SO3 ④CCl4⑤石墨 ⑥浓硫酸 ⑦液态醋酸 ⑧碳酸钙 ⑨熔融KCl中,(填编号,下同)
属于强电解质的是____________________,属于非电解质的是__________________,能导电的是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.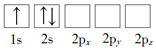 B.
B.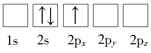
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
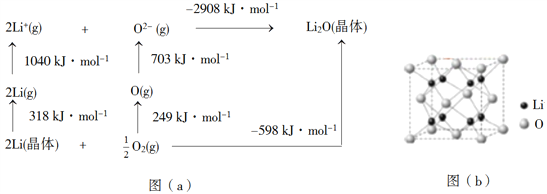
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlPO4的沉淀溶解平衡曲线如图所示(T2>T1).下列说法正确的是( )
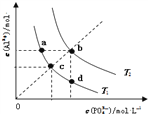
A. 图象中四个点的Ksp:a=b>c>d
B. AlPO4在b点对应的溶解度大于c点
C. AlPO4(s)Al3+(aq)+PO43-(aq)△H<0
D. 升高温度可使d点移动到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源、环境与生产生活和社会发展密切相关。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到平衡状态的是_________(填字母)。
a.v(CO2)消耗=v(CH3OH)生成 b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变 d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_________(填字母)。
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
③cl_________c2(填“>”、“<”或“=”),a=_________。
④该温度下反应的平衡常数K=_________;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=_________。
(2)已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
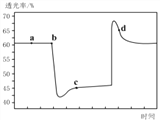
A.b点的操作是压缩注射器
B.d点:v正>v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6.5gZn放入足量的盐酸中,锌完全反应。计算:
(1)6.5gZn的物质的量?
(2)参加反应的HCl的物质的量?
(3)生成氢气的体积(标准状况)?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com