
| A. | O2是还原产物 | B. | Na2O2是氧化剂,水是还原剂 | ||
| C. | NaOH是氧化产物 | D. | Na2O2中,氧既得电子,又失电子 |
分析 Na2O2中O元素化合价为-1价,在2Na2O2+2H2O═4NaOH+O2↑的反应中,只有O元素的化合价发生变化,Na2O2既是氧化剂又是还原剂.
解答 解:Na2O2中O元素化合价为-1价,在2Na2O2+2H2O═4NaOH+O2↑的反应中,只有O元素的化合价发生变化,Na2O2既是氧化剂又是还原剂;
A.O2既是还原产物又是氧化产物,故A错误;
B.Na2O2既是氧化剂又是还原剂,水未参加氧化还原反应,故B错误;
C.NaOH既不是还原产物又不是氧化产物,故C错误;
D.Na2O2既是氧化剂又是还原剂,Na2O2中,-1价的氧既得电子,又失电子,故D正确;
故选D.
点评 本题考查过氧化钠的性质,侧重于学生的分析能力的考查,为高考高频考点,注意从元素化合价的角度分析氧化还原反应,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯分子中有3个C-C键和3个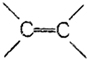 键 键 | |
| B. | 苯分子中的碳碳键是一种介于C-C键和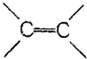 键之间的特殊的键 键之间的特殊的键 | |
| C. | 苯分子中的6个碳碳键不是完全相同的 | |
| D. | 苯分子具有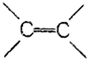 键可以使溴水褪色 键可以使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 金属质量/g | 金属 状态 | c(H2SO4) /mol/L | V(H2SO4)/mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.24 | 丝 | 0.5 | 100 | 20 | 34 | 500 |
| 2 | 0.24 | 粉末 | 0.5 | 100 | 20 | 35 | 50 |
| 3 | 0.24 | 丝 | 0.7 | 100 | 20 | 36 | 250 |
| 4 | 0.24 | 丝 | 0.8 | 100 | 20 | 35 | 200 |
| 5 | 0.24 | 粉末 | 0.8 | 100 | 20 | 36 | 25 |
| 6 | 0.24 | 丝 | 1.0 | 100 | 20 | 35 | 125 |
| 7 | 0.24 | 丝 | 1.0 | 100 | 35 | 50 | 50 |
| 8 | 0.24 | 丝 | 1.1 | 100 | 20 | 34 | 100 |
| 9 | 0.24 | 丝 | 1.1 | 100 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸与pH=11的氢氧化钾 | |
| B. | 0.1 mol/L的盐酸与0.1 mol/L的氨水 | |
| C. | 0.001 mol/L的盐酸与pH=11的氨水 | |
| D. | pH=3的盐酸与0.001 mol/L的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-Cl | C-Br |
| 键能9kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp | 1.8×10-10 | 5×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
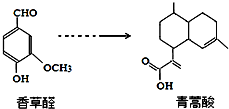 下列叙述正确的是( )
下列叙述正确的是( )| A. | 青蒿酸分子能在NaOH溶液中发生水解反应 | |
| B. | 在一定条件下,香草醛分子最多有16个原子共面 | |
| C. | 两种物质分别和H2反应,最多消耗H24mol和3mol | |
| D. | 用FeCl3溶液或NaHCO3溶液都可以鉴别香草醛和青蒿酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
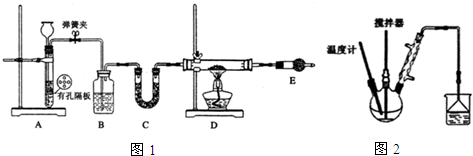
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com