
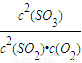 计算;
计算;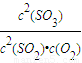 =
= =1600
=1600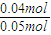 ×100%=80%
×100%=80%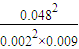 =6.4×104>1600,反应不处于平衡状态,平衡逆向移动,向生成SO2的方向移动;
=6.4×104>1600,反应不处于平衡状态,平衡逆向移动,向生成SO2的方向移动;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题:| 弱酸化学式 | CH3COOH | HCN | H2CO |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
| 放电 |
| 通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
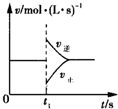 可逆反应2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
可逆反应2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )| A、维持温度、容积不变,t1时充入SO3(g) | B、维持压强不变,t1时升高反应体系温度 | C、维持温度、容积不变,t1时充入一定量Ar | D、维持温度、压强不变,t1时充入SO3(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com