
| A. | 化学反应必然伴随能量的变化 | |
| B. | 我国目前使用的主要能源是化石能源 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 化学反应一定有化学键的断裂与形成 |
分析 A.化学反应实质是旧键断裂,同时新键形成,反应过程中一定伴随能量变化;
B.化石能源指煤、石油、天然气;
C.反应吸热、放热与反应条件无关;
D.化学反应的实质是旧键断裂和键形成.
解答 解:A.化学反应实质是旧键断裂,同时新键形成,反应过程中一定伴随能量变化,故A正确;
B.我国目前使用的主要能源是煤、石油、天然气等化石能源,故B正确;
C.反应吸热、放热与反应条件无关,有些吸热反应不需要加热,如氢氧化钡晶体和氯化铵的反应,故C错误;
D.化学反应的实质是旧键断裂和键形成,故D正确;
故选C.
点评 本题考查了化学反应能量变化的实质和分析判断,主要是反应实质的理解应用,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②④⑥ | C. | ①②⑤⑥ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用加热NH4Cl固体的方法制备NH3 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 工业上用SO2漂白纸浆、毛、丝、草帽辫等 | |
| D. | 保存金属钠的仓库着火可以用二氧化碳灭火器去灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气、二氧化硫都能使品红溶液褪色,它们的漂白原理相同 | |
| B. | 纯净的晶体硅是现代光学及光纤制品的基本原料 | |
| C. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 | |
| D. | NH3的水溶液可以导电,所以NH3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5g | |
| B. | 将40g氢氧化钠溶解在1L水中可配制物质的量浓度为1mol/L的氢氧化钠溶液 | |
| C. | 气体摩尔体积指lmol任何气体所占的体积约为22.4L | |
| D. | 10毫升1mol/L氯化铝溶液与50毫升3mol/L氯化钠溶液中所含氯离子物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L NH3中含有的氢原子数为1.5NA | |
| B. | 0.2mol/L AlCl3溶液含有0.2NA个Al3+ | |
| C. | 常温常压下,18g水的原子数为3NA | |
| D. | O2与O3的混合物32g,含有分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 氯气通入下列溶液中 | 实验现象 | 结论 |
| A | 滴有KSCN的FeCl2溶液 | 变红 | 氯气具有还原性 |
| B | 滴有酚酞的NaOH溶液 | 褪色 | 氯气具有漂白性 |
| C | 紫色石蕊溶液 | 先变红后褪色 | 氯气具有酸性、漂白性 |
| D | 少量氯气通入大量水中 | 溶液pH<7 呈浅黄绿色 | 氯气与水反应生成酸性物质, 且该反应为可逆反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
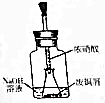 我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].
我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com