
| A.pH=1的溶液中:Fe2+、ClO-、Na+、SO42- |
| B.在含较多Al3+的溶液中:K+、Cl-、HCO3- |
| C.NH4HSO4溶液与过量NaOH稀溶液反应:NH4++OH-=NH3?H2O |
| D.向小苏打溶液中加入NaOH固体:HCO3-+OH-=CO32-+H2O |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.在透明的溶液中:Fe2+、H+、I- |
| B.在pH=1的溶液中:Cl-、NH4+、ClO- |
| C.滴加KSCN试剂呈红色的溶液中:K+、SO32-、HCO3- |
| D.在与Al能够放出氢气的溶液中:CH3COO-、F-、Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=1的溶液中,NO3-、Na+、I-、Fe2+ |
| B.有CO32-存在的溶液中:Na+、Al3+、Ca2+、I- |
| C.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
| D.pH=13的无色透明溶液中,K+、Na+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H+、Ba2+、HCO3-、Cl- | B.K+、Fe3+、I-、NO3- |
| C.NH4+、AlO2-、Cl-、OH- | D.K+、SO42-、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在pH=13的溶液中:Na+、Ba2+、Cl-、NO3- |
| B.使石蕊试液变红的溶液:Na+、ClO-、Cl-、NO3- |
| C.无色溶液:Cu2+、K+、SO42-、Cl- |
| D.强碱性溶液:K+、Mg2+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+、Na+、AlO2-、NO3- | B.Al3+、Mg2+、SO42-、Cl- |
| C.Fe2+、NO3-、Cl-、SO42- | D.Fe3+、I-、ClO-、Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
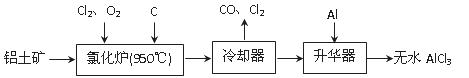
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com