
���к͵ζ����ⶨ�ռ�Ĵ��ȣ����ռ��к��������Ӧ�����ʣ��Ը���ʵ��ش�
��1����ȷ��ȡ��4.3 g�ռ���Ʒ���Ƴ�250 mL����Һ����Ҫ����Ҫ��������Ͳ���ձ�������������ͷ�ι��⣬�������õ��������� ��
��2��ȡ����Һ10.00 mL���� �ζ�����ȡ����������ƿ�С�
��3������ƿ�еμӼ���ָʾ������0.200 mol��L-1������ζ������ռ���Һ��������ѡ�õ�ָʾ��Ϊ��ѡ����ţ���________����ʯ����Һ ����ɫ��̪ �ۼ�����Һ
��4���������εζ���õ�ʵ���������±����ó��ռ�Ĵ���Ϊ ��
| �ζ����� | ����Һ�����mL�� | �����������mL�� | |
| �ζ�ǰ������mL�� | �ζ��������mL�� | ||
| ��һ�� | 10.00 | 0.50 | 20.40 |
| �ڶ��� | 10.00 | 4.00 | 24.10 |
��5�����в����п���ʹ�����ռ���Һ��Ũ����ֵƫ�͵��ǣ�ѡ����ĸ�� ��
A����ʽ�ζ���δ���������Һ��ϴ��ֱ��ע���������Һ
B����ƿ������ˮϴ����û�и����ע��NaOH����Һ
C��װ���������Һ����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D����ȡHCl��Һ���ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
E�����ռ���ָʾ���ֲ�����ɫ�б仯��ֹͣ�ζ�
 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
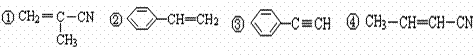 ��5����
��5����
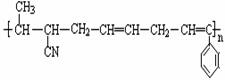
��CH2��CH��CH��CH2 ��
���п����ںϳɸ߷��Ӳ���
���ṹ����ͼ��ʾ������ȷ���Ϊ���� ��
A���٢ڢ� B���٢ڢ� C���ڢܢ� D���ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1,2 ����������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ�2.18 g��cm��3���е�131.4�棬�۵�9.79�棬������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ�����п�������ͼ��ʾװ���Ʊ�1,2 ���������顣���з�Һ©������ƿa��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Һ��(���渲������ˮ)��

��д���пհף�
��1��д���������Ʊ�1,2-���������������ѧ��Ӧ����ʽ��_ �� ��
��2����ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������д����������ʱƿb�е�����____________________________________________��
��3������c��NaOH��Һ�������ǣ�________________________________________��
��4��ijѧ��������ʵ��ʱ��ʹ��һ������Һ�壬����ȫ����ɫʱ���������Ҵ���Ũ������Һ����������������³������ࡣ���װ�õ�������û�����⣬�Է�������ܵ�ԭ�� _____�� _____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��̬��1 mol ǡ����2 mol HCl�ӳɣ�����������е����ֿɱ�6 mol Cl2ȡ���������̬��������
A��C2H2 B��C2H4 C��CH��C��CH3 D��CH2=C(CH3)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�谢���ӵ�������ֵΪNA������˵������ȷ����
A��1 mol ����ϩ�к��е�C=C��Ϊ4 NA
B��2.8 g ��ϩ�ͱ�ϩ�Ļ������������̼ԭ����Ϊ0.2 NA
C��0.1 mol CnH2n+2�к��е�C��C����Ϊ0.1n NA
D����״���£�2.24 L CCl4���еķ�����Ϊ0.1 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
NAΪ�����ӵ�����������������ȷ����
A��10 g H218O���е�������Ϊ5NA
B��1 mol�ǻ�(-OH)���еĵ�����Ϊ10NA
C��1 mol �����μӷ�Ӧʱ������ת����Ŀһ��Ϊ2NA
D����״���£�11.2L���麬�еķ�����Ϊ0.5 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��


�ŷ�Ӧ���� ������ȡ����ȡ�����Ӧ��
 ��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ(P)�Ĺ�ϵ����ͼ��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A) K(B)������������������������ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3= ����K1��K2��ʾ����
��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ(P)�Ĺ�ϵ����ͼ��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A) K(B)������������������������ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3= ����K1��K2��ʾ����
����3 L�ݻ��ɱ���ܱ������з�����Ӧ�ڣ���֪c(CO)�뷴Ӧʱ��t�仯���ߢ���ͼ��ʾ������t0ʱ�̷ֱ�ı�һ�����������ߢ��Ϊ���ߢ�����ߢ�
�����ߢ��Ϊ���ߢ�ʱ���ı�������� ��
�����ߢ��Ϊ���ߢ�ʱ���ı�������� ��
�ȼ״�ȼ�ϵ�����Ź㷺����;��ͬʱAl-AgO�����Ӧ�ù㷺������أ���ԭ����ͼ��ʾ���õ�صĸ�����Ӧʽ�� ��
��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᡣͨ��״���£���a mol/L�Ĵ�����b mol/LBa(OH)2��Һ�������ϣ���Ӧƽ��ʱ��2c(Ba2��)= c(CH3COO��)���ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪25 �桢101 kPa�£���1 mol̼ԭ�ӵ�ʯī��ȫȼ������CO2�ų�����393.51 kJ����1 mol̼ԭ�ӵĽ��ʯ��ȫȼ������CO2�ų�395.41 kJ���������ݴ��жϣ�����˵����ȷ���ǣ� ��
A����ʯī�Ʊ����ʯ�����ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĵ�
B����ʯī�Ʊ����ʯ�����ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĸ�
C����ʯī�Ʊ����ʯ�Ƿ��ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĵ�
D����ʯī�Ʊ����ʯ�Ƿ��ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����0.1 mol��L��1 NH4Cl��Һ������˵������ʽ��ȷ����
A�������¶ȣ���ҺpH���� B��ͨ������HCl��c(NH4��)��c(Cl��)������
C��c(NH4��) + c(OH��)��c(Cl��)+ c(H+) D��c(Cl��) > c(H+) > c(NH4��) > c(OH��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com