
| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
阅读分析材料,据此完成下列要求
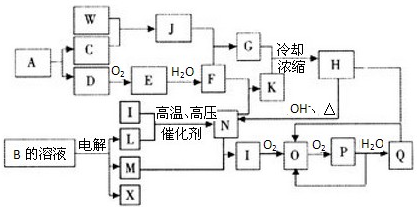
 A到N为中学化学常见物质或该物质的水溶液,且它们之间存在如下转化关系
A到N为中学化学常见物质或该物质的水溶液,且它们之间存在如下转化关系
其中,A是生活的必需品,其焰色反应呈黄色;B为二元强酸;D为氢化物;E在地壳中的含量居第三位,其单质大量用于制造导线和合金;J是普通干电池的重要成分;C为酸式盐;F的水溶液与少量的过氧化钠反应也可得到I;G是一种不溶于稀硝酸的白色沉淀;M在L气体中燃烧产生棕黄色烟。
⑴A的晶体类型为 ,C的化学式为 。
⑵M的化学式为 ;若N的水溶液呈蓝绿色,则M与B反应的化学方程
式为: 。
⑶D的浓溶液与J反应的离子方程式为: 。F的水溶液与过量的过氧化钠反应的离子方程式为: 。
⑷H溶液中各离子浓度由小到大的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
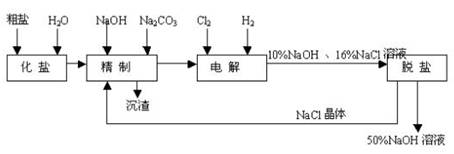
依据上图,完成下列填空:
(1)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
,
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
(选填a、b、c,多选扣分)
A. Ba(OH)2 B. Ba(NO3)2 C. BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
(选填a,b,c多选扣分)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(4)电解过程的总反应方程为 。
(5)电解槽阳极产物可用于
(至少写出两种用途)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化氢的含量
步骤如下并填写下列空白:
(1)将10.00 mL密度为ρ g/mL的过氧化氢溶液稀释至250mL。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,作被测试样。此过程中需要用到的定量仪器 。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请完成该反应方程:___MnO4- + __H2O2 + ___H+ → ___Mn2+ + __H2O +__ _____
(3) 滴定时,将高锰酸钾标准溶液注入滴定管中,滴定到达终点的现象是_____________________ ___。
(4)重复滴定二次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为___________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____(填“偏高”“偏低”“不变”)。
Ⅱ.探究过氧化氢的性质
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、二氧化锰,实验仪器及用品可自选。)
请将他们所选的实验试剂和实验现象填入下表:(只要完成其中一项探究即可)
| 实 验 内 容 | 实 验 试 剂 | 实 验 现 象 |
| 探究氧化性 |
|
|
| 或探究不稳定性 |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
,
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
(选填a、b、c,多选扣分)
A. Ba(OH)2 B. Ba(NO3)2 C.BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
(选填a,b,c多选扣分)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(4)电解过程的总反应方程为 。
(5)电解槽阳极产物可用于
(至少写出两种用途)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com