
 $→_{△}^{-H_{20}}$CH3CH=CHCHO,水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
$→_{△}^{-H_{20}}$CH3CH=CHCHO,水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
分析 一元醇A中氧的质量分数约为21.6%,设该饱和一元醇的化学式为CnH2n+2O,氧元素的质量分数=$\frac{16}{14n+2+16}$,则n=4,且A中只有一个甲基,所以该一元醇是1-丁醇,在铜作催化剂、加热条件下,A被氧气氧化生成B丁醛,丁醛和氢氧化钠的水溶液发生反应生成 C,结合题给信息知,C的结构简式为:CH3CH2CH2CH=C(CH2CH3)CHO,C反应生成D,D的相对分子质量是130,则C和氢气发生加成反应生成D,则D的结构简式为:CH3CH2CH2CH2CH(CH2OH)CH2CH3,D和邻羟基苯甲酸发生酯化反应生成E,E的结构简式为: ,结合物质的结构和性质解答.
,结合物质的结构和性质解答.
解答 解:一元醇A中氧的质量分数约为21.6%,设该饱和一元醇的化学式为CnH2n+2O,氧元素的质量分数=$\frac{16}{14n+2+16}$,则n=4,且A中只有一个甲基,所以该一元醇是1-丁醇,在铜作催化剂、加热条件下,A被氧气氧化生成B丁醛,丁醛和氢氧化钠的水溶液发生反应生成 C,结合题给信息知,C的结构简式为:CH3CH2CH2CH=C(CH2CH3)CHO,C反应生成D,D的相对分子质量是130,则C和氢气发生加成反应生成D,则D的结构简式为:CH3CH2CH2CH2CH(CH2OH)CH2CH3,D和邻羟基苯甲酸发生酯化反应生成E,E的结构简式为: ,
,
(1)通过以上分析知,A的分子式为:C4H10O,结构分析显示A只有一个甲基,A的名称为1-丁醇,故答案为:C4H10O,1-丁醇(或正丁醇);
(2)加热条件下,丁醛和新制氢氧化铜反应生成丁酸钠、氧化亚铜和水,反应方程式为:CH3CH2CH2CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O,
故答案为:CH3CH2CH2CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O;
(3)C的结构简式为:CH3CH2CH2CH=C(CH2CH3)CHO,有顺式和反式两种结构,C中含有醛基和碳碳双键,都能和溴水反应,要检验两种官能团,则应先用银氨溶液检验醛基,然后再用溴水检验碳碳双键,所以所加试剂先后顺序是:银氨溶液、稀盐酸、溴水,
故答案为:2;银氨溶液、稀盐酸、溴水;
(4)D的结构简式为:CH3CH2CH2CH2CH(CH2OH)CH2CH3,D中所含有的官能团为羟基,根据上面的分析可知,第④步的反应类型为取代反应(酯化反应),
故答案为:羟基;取代反应(酯化反应);
(5)根据条件a.分子中有6个碳原子在一条直线上,则该分子中含有两个碳碳三键:b.分子中所含官能团包括水杨酸具有的官能团,则该分子中含有一个羟基和一个羧基,则符合条件的水杨酸同分异构体的结构简式为:HOCH2C≡C-C≡CCH2COOH、 、HOCH2CH2C≡C-C≡C-COOH、
、HOCH2CH2C≡C-C≡C-COOH、 ,共有4种,故答案为:4.
,共有4种,故答案为:4.
点评 本题考查有机物的推断,正确推断出A物质是解本题关键,结合题给信息进行分析解答,难度中等,注意溴水能氧化醛基,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
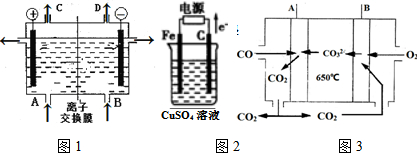
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同种物质 | B. | 不同密度的核素 | ||
| C. | 同位素 | D. | 相同元素构成的不同单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨的喷泉实验:圆底烧瓶 | B. | 实验室制氧气:试管 | ||
| C. | 中和滴定:锥形瓶 | D. | 中和滴定:滴定管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
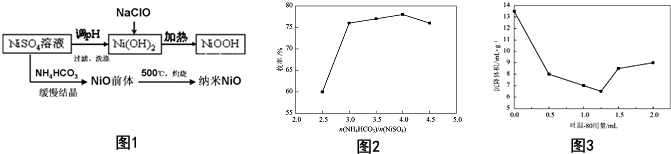
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

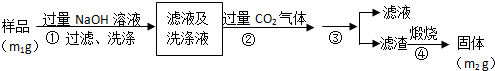
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
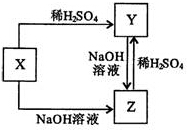
| A. | W可能是非金属元素 | |
| B. | X可能是氧化物 | |
| C. | Y、Z之间的转化可能是氧化还原反应 | |
| D. | Y和Z在溶液中反应可能生成X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 51% | B. | 56% | C. | 57% | D. | 10% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com