



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q | ||
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | ||
| C、若平衡体系共有气体a mol,再向其中加入b mol B,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n=p+q | ||
D、温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在空气中燃烧,生成淡黄色的氧化钠粉末 |
| B、镁在CO2中燃烧,生成白色的氧化镁和黑色的碳 |
| C、将灼热的铁丝放入盛有氯气的集气瓶中,生成棕黄色的氯化铁烟雾 |
| D、在铜和浓硫酸加热反应后的混合液中加水,得到无色硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 结论或解释 | 实验事实 | |
| A | 该溶液中溶质的质量分数为3.84%,其物质的量浓度为1mol?L-1 | 将40g NaOH溶于1L蒸馏水中 |
| B | 常温下,S(AgCl)< S(AgI) | 向盛有1mL 0.1mol?L-1AgNO3溶液的试管中滴加0.1mol?L-1NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol?L-1 KI溶液,白色沉淀转化为黄色沉淀 |
| C | 酸HX为弱酸 | 某盐NaX溶液的pH>7 |
| D | 还原性Al<Cu | 向盛有浓硝酸的试管中分别加入Al片和Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
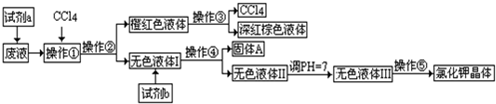
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁片改为铁粉 |
| B、稀硫酸改为98% 浓硫酸 |
| C、对该反应体系加热 |
| D、铁片改为锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、O2、SO3的物质的量浓度不再变化 |
| B、O2和SO3的化学反应速率相等 |
| C、SO2、O2、SO3的分子数之比为2:1:2 |
| D、单位时间生成2n mol SO2,同时生成n mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、1:3 |
| C、3:2 | D、1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com