
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7)。工艺流程及相关物质溶解度曲线如图:
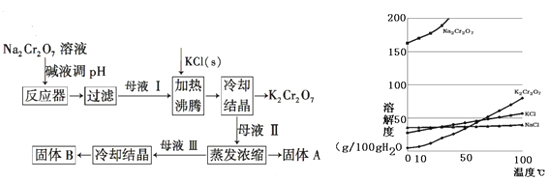
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为:________。通过冷却结晶析出大量K2Cr2O7的原因是________。
(2)向Na2Cr2O7母液中加碱液调pH的目的是_________。
(3)固体A主要为_______(填化学式),固体B主要为_________(填化学式)。
(4)为检验得到的重铬酸钾晶体中含有少量的氯化钠杂质,实验方法是:________;进一步提纯产品的方法是_________。
(5)将SO2通入用硫酸酸化的重铬酸钾溶液中,可制得硫酸铬钾KCr(SO4)2,反应的化学方程式为______;如果溶液的酸碱性控制不当,可能会有Cr(OH)SO4杂质生成。现从得到的硫酸铬钾产品中取出3.160g样品加入足量盐酸和BaCl2溶液后,得到白色沉淀5.126g。若产品中杂质只有Cr(OH)SO4,则该产品中KCr(SO4)2的质量分数为_______(用百分数表示,保留1位小数)。〖摩尔质量/g·mol-1:KCr(SO4)2:283;Cr(OH)SO4:165〗
【答案】Na2Cr2O7+2KCl=K2Cr2O7+2NaCl 低温下K2Cr2O7溶解度远小于其他组分,随温度的降低,K2Cr2O7的溶解度明显减小 除去Fe3+ NaCl K2Cr2O7 取少量重铬酸钾样品,加水溶解,加入足量的硝酸酸化后滴入硝酸银溶液,有白色沉淀生成即说明产品中含有氯化钠杂质 重结晶 K2Cr2O7+3SO2+H2SO4=2KCr(SO4)2+H2O 89.6%
【解析】
由流程可知,溶解后调节pH除去少量杂质Fe3+,过滤后蒸发结晶得到Na2Cr2O7,然后加入KCl发生Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,结合溶解度图可知,低温下K2Cr2O7的溶解度较小,则冷却结晶得到K2Cr2O7,母液II蒸发浓缩只有析出NaCl(A),母液Ⅲ冷却结晶主要得到K2Cr2O7(B),根据AgCl的难溶性来验证NaCl的存在性;利用K2Cr2O7的溶解度比同温下Na2Cr2O7的小,用重结晶方法提纯物质,以此来解答。
由流程可知,溶解后调节pH除去少量杂质Fe3+,过滤后蒸发结晶得到Na2Cr2O7,然后加入KCl发生Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,结合溶解度图可知,低温下K2Cr2O7的溶解度较小,则冷却结晶得到K2Cr2O7,母液II蒸发浓缩只有析出NaCl(A),母液Ⅲ冷却结晶主要得到K2Cr2O7(B)。
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,由溶解度图可知,低温下K2Cr2O7的溶解度远小于其它组分,随温度的降低,K2Cr2O7的溶解度明显减小,则可通过冷却结晶析出大量K2Cr2O7晶体;
(2)母液中含少量杂质Fe3+,向Na2Cr2O7母液中加碱液调pH的目的是除去杂质Fe3+离子;
(3)由上述分析可知,A为NaCl,B为K2Cr2O7;
(4)氯化钠溶于水后电离出来的氯离子和硝酸酸化的硝酸银可以生成白色难溶于酸的沉淀AgCl,故检验K2Cr2O7晶体中含有少量的氯化钠的方法是:取少量重铬酸钾样品,加水溶解,加入足量的硝酸酸化后滴入硝酸银溶液,有白色沉淀生成即说明产品中含有氯化钠杂质;K2Cr2O7的溶解度比同温下Na2Cr2O7的小,所以进一步提纯K2Cr2O7晶体可以用重结晶方法;
(5)该反应中S元素化合价由+4价变为+6价、Cr元素化合价由+6价变为+3价,转移电子数为6,根据转移电子相等配平方程式K2Cr2O7+3SO2+H2SO4=2KCr(SO4)2+H2O,5.126g白色沉淀为:BaSO4,物质的量n(BaSO4)=![]() =0.022mol,设硫酸铬钾的物质的量为x,Cr(OH)SO4的物质的量为y,依据硫酸根守恒以及质量守恒得出:2x+y=0.022mol,x×283+y×165=3.160g,解得x=0.01mol,y=0.002mol,,故KCr(SO4)2的质量分数为:
=0.022mol,设硫酸铬钾的物质的量为x,Cr(OH)SO4的物质的量为y,依据硫酸根守恒以及质量守恒得出:2x+y=0.022mol,x×283+y×165=3.160g,解得x=0.01mol,y=0.002mol,,故KCr(SO4)2的质量分数为:![]() ×100%=89.6%。
×100%=89.6%。


科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
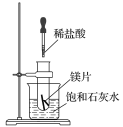
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化工生产原理正确的是
A. 工业制取烧碱:Na2O+H2O=2NaOH
B. 工业合成盐酸:H2+Cl2![]() 2HCl
2HCl
C. 工业制取乙烯:C2H5OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
D. 工业制漂粉精:2Ca(OH)2+2Cl2 =Ca(ClO)2+CaCl2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,还含有少量Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按如下流程进行生产,以制备金属镁。

本流程操作条件下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 10.0 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
*Fe2+氧氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+后生成Fe(OH)3沉淀除去。 请回答以下问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施有 __________________________ (任写一条)。
(2)步骤②中NaClO的电子式为__________,加入NaClO溶液的目的是_________________________
(用离子方程式解释)。
(3)常温时,Mg(OH)2的Ksp=1.8×10-11。当溶液pH=10.0时,溶液中的c(Mg2+)=___________。
(4)若将步骤⑤中“稀盐酸”改为“加水、煮沸”的方式可以得到另一种沉淀物和一种无色无味的气体,请写出该反应的化学方程式__________________________________________。
(5)步骤⑥中涉及的操作是_____________________________,且⑥⑦操作均需在HCl气流中进行,其原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.碳酸钠的水解反应CO32-+H2O=HCO3-+OH -
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.苯酚钠溶液与二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,下列说法正确的是
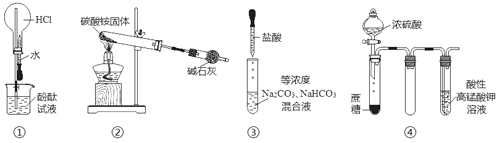
A. 实验①可观察到红色喷泉
B. 实验②可收集到少量氨气
C. 实验③中逐滴滴加稀盐酸时,试管中立即产生大量气泡
D. 实验④中酸性KMnO4溶液中有大量气泡出现,但溶液颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在一定条件下转化为金刚石,其能量变化如图所示,其中ΔE1=393.5 kJ,ΔE2=395.4 kJ,下列说法正确的是

A. 1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量
B. 石墨转化为金刚石属于物理变化
C. 金刚石的稳定性强于石墨的
D. 1 mol金刚石的能量大于1 mol CO2的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2 为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32﹣ 的中心原子均为sp3杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com