
【题目】某防晒产品中含水杨酸乙基己酯(结构简式如图)、丙烯酸(CH2= CH-COOH)、甘油(丙三醇)、水等物质。下列说法错误的是

A. 甘油具有保湿作用
B. 水杨酸乙基己酯结构中所有的碳原子均可共面
C. 水杨酸乙基己酯苯环上的一氯代物有四种
D. 丙烯酸可发生加成、取代和氧化反应
【答案】B
【解析】
A. 甘油中羟基是亲水基团,易吸水;
B. 水杨酸乙基己酯结构中有一个采用sp3杂化的碳原子与三个碳原子相连;
C. 水杨酸乙基己酯苯环上有四种氢原子;
D. 根据丙烯酸中碳碳双键、羧基官能团的性质解答。
A. 甘油中羟基是亲水基团,易吸水,甘油具有保湿作用,故A正确;
B. 水杨酸乙基己酯结构中有一个采用sp3杂化的碳原子与三个碳原子相连,呈四面体结构,水杨酸乙基己酯结构中所有的碳不可能共面,故B错误;
C. 水杨酸乙基己酯苯环上有四种氢原子,能形成四种苯环上的一氯代物,故C正确;
D. 丙烯酸中含碳碳双键,能发生加成反应、氧化反应,含羧基能发生取代,故D正确。
故选B。


科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Y、Z的族序数之和为12;X与Y的电子层数相同;向过量的ZWY溶液中滴入少量胆矾溶液,观察到既有黑色沉淀生成又有臭鸡蛋气味的气体放出。下列说法正确的是
A. ZWY是离子化合物,其水溶液呈酸性
B. 晶体X熔点高、硬度大,是信息技术的关键材料
C. 原子半径由小到大的顺序为:r(W)<r(X)<r(Y)<r(Z)
D. 最高价氧化物的水化物的酸性:H2XO3<H2YO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸亚铁(C4H2O4Fe)常用于治疗缺铁性贫血,也可作食品营养强化剂,它可由糠醛(![]() )和硫酸亚铁制备。已知
)和硫酸亚铁制备。已知![]() 。
。
回答下列问题
I.制备富马酸(实验装置如图所示,夹持装置已略去)

(1)将45.0g氯酸钠、0.2g五氧化二钒置于三颈烧瓶中,加入适量水,滴加糠醛并加热至90~100℃,维持此温度3~4h。实验中冷凝管的作用是_________,冷却液宜从___________ (填a”或“b”)处进入。
(2)冰水冷却使其结晶,并通过___________操作可以得到富马酸粗品。
(3)再用1mol·L-1HCl溶液重结晶,得到纯富马酸。该操作中用1mol·L-1HCl溶液的原因是_____________。
Ⅱ.合成富马酸亚铁
(4)取富马酸溶于适量水中,加入碳酸钠并加热、搅拌,调节pH6.5~6.7,产生大量气泡。写出该反应的化学方程式:___________。
(5)将硫酸亚铁溶液和适量的Na2SO3溶液缓慢加入上述反应液中,维持温度100℃并充分搅拌3~4h。
①该操作过程中加入适量的Na2SO3溶液,其目的是___________。
②写出生成富马酸亚铁的离子方程式:_____________。
(6)过滤、干燥得到产品。
过滤时滤纸要紧贴漏斗内壁,原因是________。
Ⅲ.产品纯度测定
(7)取0.300g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新沸过的冷水和2滴邻二氮菲指示液,此时溶液呈红色;立即用0.1000mol·L-1硫酸铈(Ⅳ)铵[(NH4)2Ce(SO4)3]标准液滴定(还原产物为Ce3+),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗17.30mL标准液,则样品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 离子化合物一定是由金属与非金属元素组成的
B. 离子化合物中可能含有离子键
C. 离子化合物中一定只含有离子键
D. 离子化合物中可能不含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
诺氟沙星为喹诺酮类抗生素,其合成路线如下:
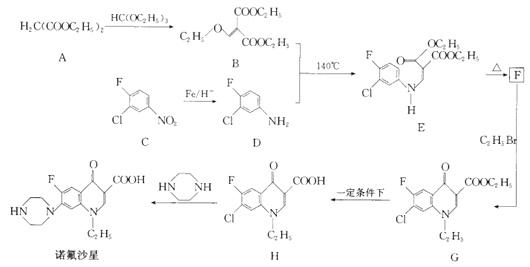
回答下列问题:
(1)化合物A的名称是____________。
(2)诺氟沙星分子中含氧官能团的名称为____________。
(3)C生成D,H生成诺氟沙星的反应类型分别是___________、___________。
(4)F的结构简式为_______________。
(5)G生成H的化学方程式为__________________。
(6)有机物X比B分子少一个CH2原子团,且含有酯基和![]() 结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
(7)参照上述合成路线写出由有机物![]() 、B为有机原料合成
、B为有机原料合成 的路线图______________(无机试剂任选)。
的路线图______________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是

A. 0-t1时,原电池的负极是铜片
B. 0-t1时,正极的电极反应式是2H++2e-=H2↑
C. t1时刻,电流方向发生变化的原因是Al 在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D. tl时刻后,电子从铝经过导线流向铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )

A. 该反应的ΔH=+91 kJ·mol-1
B. 加入催化剂,该反应的ΔH变小
C. 反应物的总能量小于生成物的总能量
D. 如果该反应生成液态CH3OH,则ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。
(1) 写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+ 6H2(g)+ O2(g)== 2CH3OCH3(g)的反应热为 ;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+ 2CO2(g)![]() CH3OCH3(g)+ 3H2O(g) △H<0
CH3OCH3(g)+ 3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是 (选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小”或“不变”)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式的其中一个产物是CO32-,请写出该反应的负极反应式 ;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 mL NaCl溶液,装置如图所示:

请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8 LO2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是( )
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,消耗标准状况下1.12 L的H2
D. H+由b极通过固体酸电解质传递到a极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com