
已知NaHC2O4溶液显弱酸性,向100mL0.1mol•L﹣1的NaHC2O4.溶液中分别加入下列物质,有关说法正确的是()
A. 加入少量H2 C2O4固体,促进水电离,溶液中c(H+)增大
B. 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42﹣)>c(HC2O4﹣)>c(H+)
C. 加入氨水至中性,则溶液中:c(NH4+)+c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)
D. 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2
考点: 离子浓度大小的比较.
分析: NaHC2O4溶液显弱酸性,说明HC2O4﹣的电离程度大于其水解程度,
A.加入H2C2O4固体后,溶液中氢离子浓度增大,抑制了水的电离;
B.恰好反应后生成Na2C2O4,C2O42﹣部分水解,溶液显示碱性,由于氢离子来自水的电离和C2O42﹣的水解,则c(H+)>c(HC2O4﹣);
C.溶液为中性,则c(H+)>c(OH﹣),根据溶液中的电荷守恒判断;
D.根据混合液中的物料守恒分析.
解答: 解:NaHC2O4溶液显弱酸性,说明HC2O4﹣的电离程度大于其水解程度,
A.酸溶液抑制了水的电离,加入H2C2O4固体后,溶液中氢离子浓度增大,则水的电离程度减小,抑制了水的电离,故A错误;
B.加入NaOH溶液至恰好完全反应生成Na2C2O4,C2O42﹣部分水解,溶液显示碱性,由于氢离子来自水的电离和C2O42﹣的水解,则c(H+)>c(HC2O4﹣),正确的离子浓度大小为:c(Na+)>c(C2O42﹣)>c(H+)>c(HC2O4﹣),故B错误;
C.中性溶液中c(H+)>c(OH﹣),根据电荷守恒可得:c(NH4+)+c(Na+)=2c(C2O42﹣)+c(HC2O4﹣),故C正确;
D.加入0.01 mol Na2C2O4固体,混合液中含有等浓度的Na2C2O4和NaHC2O4,根据物料守恒可得:2c(Na+)=3,故D错误;
故选C.
点评: 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,注意掌握判断离子浓度大小常用方法,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:
根据阿伏加德罗定律,下列叙述中正确的是()
A. 同温同压下两种气体的体积之比等于摩尔质量之比
B. 同温同压下两种气体的物质的量之比等于密度之比
C. 同温同压下两种气体的密度之比等于摩尔质量之比
D. 同温同压下两种气体的物质的量之比等于摩尔质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组性质的比较中正确的是()
A. 酸性:HClO4<H2SO4<H3PO4 B. 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
C. 稳定性:HF>HCl>PH3>H2S D. 原子半径:O>S>Na
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)()
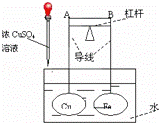
A. 杠杆为导体和绝缘体时,均为A端高,B端低
B. 杠杆为导体和绝缘体时,均为A端低,B端高
C. 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D. 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
利用图所示装置进行下列实验,能得出相应实验结论的是()
选项 ① ② ③ 实验结论 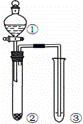
A 稀硫酸 Na2CO3 C6H5ONa 酸性:H2CO3>C6H5OH
B 液溴和苯 铁屑 AgNO3溶液 液溴和苯发生取代反应
C 稀盐酸 Na2SO3 Ba(NO3)2溶液 SO2与可溶性钡盐可以生成白色沉淀
D 浓盐酸 KMnO4 FeBr2溶液 氧化性:Cl2>Br2>Fe3+
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 升高温度能使化学反应速率增大,主要原因是增加了反应物分子 中活化分子的百分数
中活化分子的百分数
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
D. 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有热化学方程式:SO2(g)+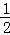 O2(g)═SO3(g)△H=﹣98.32kJ/mol现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于()
O2(g)═SO3(g)△H=﹣98.32kJ/mol现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于()
A. 40% B. 50% C. 70% D. 80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com