
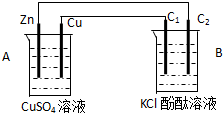
 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题分析 (1)该装置中A能自发的进行氧化还原反应为原电池,B为电解池;
(2)Zn易失电子作负极,Cu作正极,B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,阴极上氢离子放电;
(3)根据电极反应式结合电子守恒来计算即可.
解答 解:(1)A能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,B有外接电源,属于电解池,Zn易失电子作负极,Cu作正极,电极反应式为:Cu2++2e-=Cu,
故答案为:正;Cu2++2e-=Cu;
(2)Zn易失电子作负极,Cu作正极,Cu电极上铜离子得电子生成Cu,B中连接铜的电极C1为阳极,电极反应为2Cl--2e-=Cl2↑,连接锌的电极C2为阴极,电解池中阴极上氢离子放电生成氢气,电极附近溶液碱性增强,石墨棒C2附近发生的实验现象为有气泡冒出,溶液变红,
故答案为:阳;2Cl--2e-=Cl2↑;有气泡冒出,溶液变红;
(3)C2极上的反应:2H++2e-=H2↑,当产生0.224L即0.01mol气体(标准状态)时,转移电子是0.02mol,根据电极反应:Zn-2e-=Zn2+,锌的物质的量减少了0.01mol,即减小0.65g,根据电池反应式Zn+Cu2+=Cu+Zn2+,故生成铜单质是0.01mol,质量是0.64g,CuSO4溶液的质量增加了0.65g-0.64g=0.01g,
故答案为:减少;0.65;增加;0.01.
点评 本题考查学生原电池、电解池的构成条件以及工作原理知识,注意电极反应式的书写是关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林具有防腐性,可用于制备酚醛树脂 | |
| B. | 甘油具有吸水性,可用作抗冻剂 | |
| C. | 乙酸乙酯能水解,可用于制备肥皂 | |
| D. | 淀粉水解能生成葡萄糖,可用于制备乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式: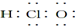 | B. | 14C的原子结构示意图: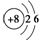 | ||
| C. | 188O2- 离子结构示意图: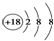 | D. | CO2的结构示为:O═C═O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖分子式为C6H12O6,是一种己醛糖,它是最简单的醛糖 | |
| B. | 人造丝、人造棉、铜氨纤维、醋酸纤维的主要成分均为纤维素 | |
| C. | 红外光谱仪、核磁共振氢谱仪、质谱仪都可用于有机物的结构分析 | |
| D. | 蛋白质的二级结构主要依靠不同肽链间亚氨基上的H与羰基上的O形成氢键而实现的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com