
分析 A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,A位于周期表的s区,其原子中电子层数和未成对电子数相同,则A是H元素;
B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B是C元素;
D原子的核外成对电子数是未成对电子数的3倍,A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,M是甲醛,则D是O元素;
C元素原子序数小于D而大于B,为N元素;
A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,为苯;
E有“生物金属”之称,E4+和氩原子的核外电子排布相同,E原子核外电子数=18+4=22,为Ti元素;
(1)E是Ti元素,其原子核外有22个电子,其外围电子为3d、4s电子,3d、4s能级上分别有2个电子;
(2)由A、B、C形成的HCN分子中,其结构式为H-C≡N,共价单键为σ键,共价三键中含有一个σ键、两个π键;
(3)a.M是甲醛,甲醛易溶于水,N是苯,苯不易溶于水,根据相似相溶原理判断;
b.M分子中C原子价层电子对个数是3且不含孤电子对,二氧化碳分子中C原子价层电子对个数是2且不含孤电子对;
c.苯分子中含有12个σ键;
d.分子晶体熔沸点小于原子晶体;
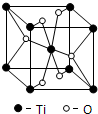
(4)利用均摊分确定化学式;每个O原子连接3个Ti原子;
(5)B、C、D分别是C、N、O元素,同一周期元素元素第一电离能随着原子序数增大而呈增大趋势但第IIA族、第VA族元素第一电离能大于其相邻元素;
(6)配位数为6、组成为TiCl3•6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,根据晶体中水分子和Cl离子个数确定化学式.
解答 解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,A位于周期表的s区,其原子中电子层数和未成对电子数相同,则A是H元素;
B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B是C元素;
D原子的核外成对电子数是未成对电子数的3倍,A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,M是甲醛,则D是O元素;
C元素原子序数小于D而大于B,为N元素;
A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,为苯;
E有“生物金属”之称,E4+和氩原子的核外电子排布相同,E原子核外电子数=18+4=22,为Ti元素,
(1)E是Ti元素,其原子核外有22个电子,其外围电子为3d、4s电子,3d、4s能级上分别有2个电子,其基态原子外围电子排布式为3d24s2,故答案为:3d24s2;
(2)由A、B、C形成的HCN分子中,其结构式为H-C≡N,共价单键为σ键,共价三键中含有一个σ键、两个π键,该分子中含有2个σ键、2个π键,故答案为:2;2;
(3)a.M是甲醛,甲醛易溶于水,N是苯,苯不易溶于水,甲醛和苯都是非极性分子,但甲醛能和水形成氢键但苯和水不能形成氢键,所以甲醛易溶于水而苯不易溶于水,故错误;
b.M分子中C原子价层电子对个数是3且不含孤电子对,二氧化碳分子中C原子价层电子对个数是2且不含孤电子对,所以甲醛中C原子采用sp2杂化,二氧化碳分子中C原子采用sp杂化,故错误;
c.苯分子中含有12个σ键,故错误;
d.分子晶体熔沸点小于原子晶体,二氧化碳是分子晶体、二氧化硅是原子晶体,则二氧化碳熔沸点小于二氧化硅,故正确;
故选d;
(4)该晶胞中Ti原子个数=1+8×$\frac{1}{8}$=2、O原子个数=2+4×$\frac{1}{2}$=4,所以其化学式为TiO2;每个O原子连接3个Ti原子,氧原子配位数是3,
故答案为:TiO2;3;
(5)B、C、D分别是C、N、O元素,同一周期元素元素第一电离能随着原子序数增大而呈增大趋势但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能大小顺序是N>O>C,
故答案为:N>O>C;
(6)配位数为6、组成为TiCl3•6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,而晶体中只含有3个Cl-,所以配体数目多的是H2O,H2O和Cl-比值为5:1,所以该配离子的化学式为[TiCl(H2O)5]2+,
故答案为:[TiCl(H2O)5]2+.
点评 本题考查物质结构和性质,较综合,涉及配合物、元素周期律、晶胞计算、原子核外电子排布等知识点,明确原子结构、物质结构及元素周期律是解本题关键,侧重考查学生判断、空间想象及知识灵活运用能力,注意元素周期律中的反常现象,注意:苯分子中存在12个σ键而不是6个σ键,为易错点.


科目:高中化学 来源: 题型:解答题
 有可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15.
有可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 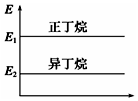 正丁烷与异丁烷的能量大小关系如图 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com