
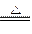 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O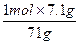 ="0.1" mol
="0.1" mol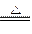 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O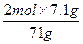 ="0.2" mol
="0.2" mol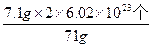 =1.204×1023个
=1.204×1023个 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O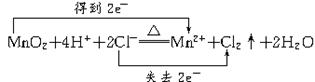


科目:高中化学 来源:不详 题型:单选题
| A.Mg和Ag | B.Cu和Zn | C.Mg和Fe | D.Al和Mg |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol | B.2 mol | C.6.02×1023 | D.1.204×1024 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有蓝色沉淀生成 | B.无沉淀生成 |
| C.有白色沉淀AgCl生成 | D.有白色沉淀BaSO4生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶2 | B.2∶1 | C.1∶4 | D.4∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.油滴的体积 | B.油滴的质量 |
| C.油酸的摩尔体积 | D.油酸的摩尔质量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 )依次为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,(设混合液的体积为各溶液体积之和)则K2SO4溶液、Fe2(SO4)3溶液及水混合时体积比是( )
)依次为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,(设混合液的体积为各溶液体积之和)则K2SO4溶液、Fe2(SO4)3溶液及水混合时体积比是( )| A.1∶2∶1 | B.1∶1∶2 |
| C.2∶1∶1 | D.4∶2∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com