
【题目】近年科学家提出“绿色自由”构想。把含有CO2的空气吹入K2CO3溶被中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示,下列有关说法不正确的是
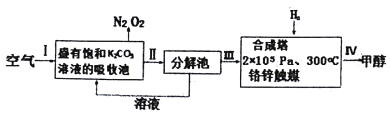
A. I、II两步目的是为了富集CO2
B. 从合成塔中及时分离出甲醇可以提高CO2的转化率
C. 过程中K2CO3可以循环使用
D. 铬锌触媒催化剂可以改变合成甲醇的焓变
科目:高中化学 来源: 题型:
【题目】近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放。蚀刻液主要有酸性的(HCl-H2O2)、传统的FeCl3型(HCl-FeCl3)等方法.蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失.几种蚀刻废液的常用处理方法如下:
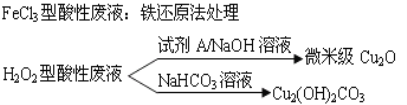
(1)FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还有_______________、__________________.(用离子方程式表示)。
(2)HCl-H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:__________。
(3)处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
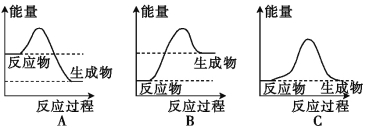
【题目】化学反应中的能量变化是人类获取能量的重要途径。
(1)液化气是一种重要的家用燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是 (填字母)。
(2)“冰袋”可用于短时间保鲜食物。将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温。由此判断:碳酸钠晶体与硝酸铵晶体的总能量 (填“高于”或“低于”)反应后生成产物的总能量。
(3)化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化。比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为 和 ;人们普遍使用的干电池工作时是将化学能转化为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 12.4gP4中所含共用电子对总数为0.4NA
B. 25℃时,pH=l的HC1溶液中含有H+的数目为0.1NA
C. 标准状况下,19gH218O2中所含电子总数为9NA
D. 1molSO2与0.5molO2在容积为V的容器中充分反应后转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是

A. 曲线a表示Fe(OH)2饱和溶液中的变化关系
B. 除去CuSO4溶液中含有的少量Fe2+,可加入适CuO
C. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6 :1
D. 向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
(提出猜想)
猜想1:__________________________________;
猜想2:__________________________________;
猜想3:__________________________________。
为了验证猜想,该小组设计实验加以探究。
(实验探究)
该小组同学按如图所示装置,将气体从a端通入。
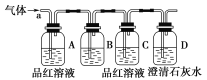
(1)B中应该放________试剂(填编号)。
a.NaCl溶液 B.酸性KMnO4溶液
c.盐酸 D.澄清石灰水
(2)A中品红溶液的作用是_________________________________________。
(3)D中澄清石灰水的作用是_______________________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色
②C中品红溶液不褪色
③D中澄清石灰水变浑浊
(得出结论)
(4)由上述现象该小组同学确认该气体为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、X存在如图所示转换关系,其中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。X可能是强酸,也可能是强碱。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)A的化学式是________。
(2)若X是强酸,将D与Cl2同时通入水中发生反应的离子方程式为____________________。
(3)若X是强碱,过量的B跟Cl2反应除生成C外,另一产物是氯化物。
①过量的B跟Cl2反应的化学方程式为___________________________。
②工业生产中B→D的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将等体积的NO和O2一同置于试管中,并将试管倒立于水中,充分反应后剩余气体的体积约为原气体总体积的( )
A. 1/4 B. 3/4
C. 1/8 D. 3/8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com