
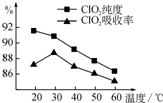
 某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示.
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示.分析 (1)由图可知,30℃时纯度较高、吸收率最大;水浴加热可控制温度恒定;
(2)FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2),Cl元素的化合价降低,Fe、S元素的化合价升高.
(3)以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标,结合Cr2O72-~~~~~~~~~6Fe2+、ClO2~~~~~5Fe2+计算.
解答 解:(1)ClO2气体的纯度,且会影响ClO2的吸收率,依据图象分析温度再30°C时ClO2的吸收率最大纯度90%以上,控制100°C以下的 温度需要用水浴加热;
故答案为:30;水浴加热;
(2)用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,氯酸跟离子在酸溶液中具有强氧化性,氧化FeS2为硫酸铁和硫酸,本身被还原为反应的离子方程式为ClO2;结合原子守恒、电子守恒配平写出离子方程式为:15ClO3-+FeS2+14H+═15ClO2+Fe3++7H2O+2SO42-;
故答案为:15ClO3-+FeS2+14H+═15ClO2+Fe3++7H2O+2SO42-;
(3)由4H++ClO2+5Fe2+═Cl-+5Fe3++2H2O
14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O可知,
Cr2O72-~~~~~~~~~6Fe2+
1 6
0.050 0mol•L-1×0.020L 0.006mol
ClO2~~~~~5Fe2+
1 5
0.0025mol 0.037L×0.500mol•L-1-0.006mol
400mL ClO2溶液中含ClO2 0.0025mol×20=0.05mol;
以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标,所以产率=$\frac{0.05mol×67.5g/mol}{0.6g}$×100%=56.25%,
答:ClO2的“产率”为56.25%.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中物质的量关系为解答的关键,侧重分析与计算能力的考查,注意守恒法及关系法应用,题目难度不大.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:多选题
| A. | 氯气通入石灰乳中,制取漂白粉 | |
| B. | 自来水厂可用明矾对水进行消毒杀菌 | |
| C. | 实验室保存氯化铁溶液时加少量盐酸,目的是防止Fe3+水解 | |
| D. | 常温下浓硝酸与铝、铁均不反应,可用铝或铁制的容器存放浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | ||
| 铝 | X | 硫 | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充入1mol稀有气体氦(He),平衡将不发生移动 | |
| B. | 充入A、B、C各1mol,平衡将向正反应方向移动 | |
| C. | 将A、B、C各物质的物质的量都减半,C的百分含量不变 | |
| D. | 加入正催化剂,正逆反应速率均加快,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 | |
| B. | 在含有0.1mol•L-1 Fe3+的溶液中:SCN-、Cl-、K+不能大量共存 | |
| C. | 在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小 | |
| D. | 常温下,水电离出c(H+)=10-10的溶液中:Na+、ClO-、S2-、NH4+不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、SO42-、NO3- | B. | Na+、K+、Al3+、NO3- | ||
| C. | K+、Mg2+、Cl-、SO42- | D. | NH4+、Cl-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
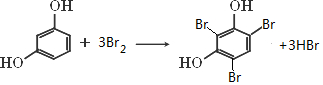
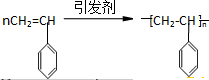
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com