
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | CH2F2的电子式: | D. | 甲醛的结构式: |
分析 A.乙烯的结构简式中漏掉了碳碳双键;
B.分子式是用元素符号表示物质(单质、化合物)分子的组成及相对分子质量的化学式;
C.该电子式中漏掉了F原子最外层的3对孤电子对;
D.用短线代替所有共用电子对即为结构式.
解答 解:A.烯烃的结构简式中碳碳双键不能省略,故乙烯的结构简式应为:CH2═CH2,故A错误;
B.CH3CH2OH为乙醇的结构简式,乙醇的分子式为C2H6O,故B错误;
C.该电子式中,F原子最外层达到8电子稳定结构,其正确的电子式为: ,故C错误;
,故C错误;
D.甲醛分子中含有1个碳氧双键、两个碳氢键,其结构式为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构式、结构简式、分子式等知识,注意熟练掌握常见化学用语的概念及书写原则,试题侧重考查学生的规范答题能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 A~J为中学化学中常见的几种物质.它们有如图转化关系:
A~J为中学化学中常见的几种物质.它们有如图转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂为I2 | |
| C. | 该反应中还原剂为KClO3 | |
| D. | 该反应中KClO3被还原为Cl2,I2被氧化为KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
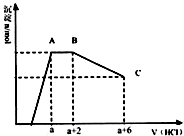 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )| A. | 原溶液肯定含有OH-,CO32-,AlO2-,SiO32- | |
| B. | K+和Na+至少含有其中一种 | |
| C. | n(CO32-):n(AlO2-)=3:2 | |
| D. | a值肯定大于$\frac{4}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 解释或结论 | |
| A | 常温下铁、铝均不溶于浓硫酸 | 常温下铁、铝与浓硫酸均不反应 |
| B | 测定同浓度的Na2CO3溶液的pH小于Na2SiO3溶液的pH | 非金属性:C<Si |
| C | 向某溶液中加入2滴KSCN浓液、溶液不显红色;再向溶液中加入几滴新制氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 用浓、稀硝酸分别完全溶解等质量的铜粉,参加反应的硝酸的物质的量比较:稀硝酸中的<浓硝酸中的 | 稀硝酸氧化性比浓硝酸强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )| A. | 如图是滴定盐酸的曲线 | |
| B. | 当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) | |
| C. | B点时,反应消耗溶液体积:V(NaOH)<V(HA) | |
| D. | E点时溶液中离子浓度为c(Na+)=c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 化学平衡发生移动时,化学反应速率一定变化 | |
| C. | 正反应进行的程度越大,正反应速率一定越大 | |
| D. | 使化学反应速率发生变化,而化学平衡不移动的影响因素,一定是催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
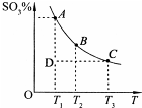 硫酸的年产量可以用来衡量一个国家的化工生产能力.工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)?2SO3(g).反应体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
硫酸的年产量可以用来衡量一个国家的化工生产能力.工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)?2SO3(g).反应体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com