
对可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则图象中关于X、Y、Z、W四种物质的聚集状态正确的说法为( )
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则图象中关于X、Y、Z、W四种物质的聚集状态正确的说法为( )
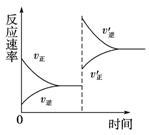
A、Z、W均为气体,X、Y中有一种是气体
B、Z、W中有一种是气体,X、Y皆非气体
C、X、Y、Z、W皆非气体
D、X、Y均为气体、Z、W中有一种为气体
科目:高中化学 来源: 题型:
某无色溶液含有Na+、Fe3+、Cl-、SO42-中的2种离子,分别取该溶液进行了下列实验:
(1)向溶液中滴加用硝酸酸化的AgNO3溶液,有白色沉淀产生;
(2)向溶液中滴加Ba(NO3)2溶液,没有任何现象。
根据上述实验,可以确定溶液中一定存在的离子是 ( )
A.Fe3+和Cl- B. Na+和SO42- C. Fe3+ 和SO42- D. Na+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色。下列结论正确的是
A.一定有Fe2+,一定没有Fe3+、Mg2+
B.一定有F e3+,一定没有Fe2+、Mg2+
e3+,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+,一定没有Mg2+
D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解某溶液时,发现两极只有H2和O2生成。则电解一段时间后,下列有关该溶液(与电解前同温度)的说法中,正确的有( )
①该溶液的pH值可能增大 ②该溶液的pH值可能减小 ③该溶液的pH值可能不变 ④该溶液的浓度可能增大 ⑤该溶液的浓度可能不变 ⑥该溶液的浓度可能减小
④该溶液的浓度可能增大 ⑤该溶液的浓度可能不变 ⑥该溶液的浓度可能减小
A.三种 B.四种
C.五种 D.六种
查看答案和解析>>
科目:高中化学 来源: 题型:
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是________________________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为______________________。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是____________________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______________。
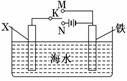 (3)利用右图装置,可以模拟铁的电化学防护。
(3)利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。若X为锌,开关K置于M处,该电化学防护法称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示。下列描述正确的是( )
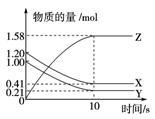
A、反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1
B、反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C、反应开始到10 s时,Y的转化率为79.0 %
D、反应的化学方程式为:X(g)+Y(g)  Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
能够说明H2(g)+I3(g)2HI(g)(HI为无色气体)已达平衡状态的是( )
A、一个H-H键断裂的同时有一个H-I键形成
B、v(正)(H2)=v(逆)(HI)时的状态
C、恒温恒容时,反应混合物总质量保持不变的状态
D、恒温恒容时,体系的颜色不再发生变化的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的两种物质作用,反应条件(温度或反应物用量)改变,不会引起产物种类改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.AlCl3和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2和液态H2O时,放出445 kJ的热量,则下列热化学方程式正确的是( )
A.2CH4(g)+4O2(g)====2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1
B.CH4(g)+2O2(g) ====CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
C.CH4(g)+2O2(g) ====CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
D.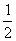 CH4(g)+2O2(g)====
CH4(g)+2O2(g)====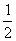 CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com