
【题目】在密闭容器中通入一定量的HI气体,使其在一定条件下发生反应:2HI(g)![]() H2(g)+I2(g)。下列叙述中,一定属于平衡状态的是
H2(g)+I2(g)。下列叙述中,一定属于平衡状态的是
A. HI、H2、I2的浓度相等
B. 混合气体的颜色不再变化
C. 混合气体的总压强不再变化
D. v(HI)∶v(H2)∶v(I2)=2∶1∶1
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应N2 (g) +3H2 (g) ![]() 2NH3 (g)的ΔH < 0,ΔS >0
2NH3 (g)的ΔH < 0,ΔS >0
B. 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C. 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol·L-1
D. 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. BF3和NH3的空间构型都为平面三角形
B. 晶格能由大到小的顺序:NaF>NaCl>NaBr>NaI
C. 熔点:Na-K合金<氯化钠<钠<金刚石
D. 空间利用率:体心立方堆积<六方最密堆积<面心立方最密堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:
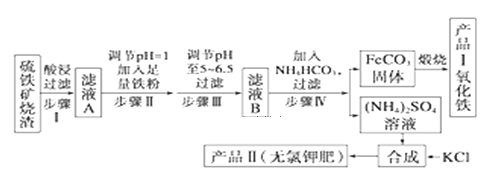
回答下列问题:
(1))古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是________(填字母) a.Fe b.FeO c.Fe2O3 d.Fe3O4
(2)酸浸、过滤后滤液A中的金属阳离子是_________,检验其中较低价态的阳离子所用试剂为________(填化学式)。煅烧FeCO3生成产品Ⅰ的化学反应方程式为_______________
(3)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为_______,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是 _____、趁热过滤、洗涤、干燥.
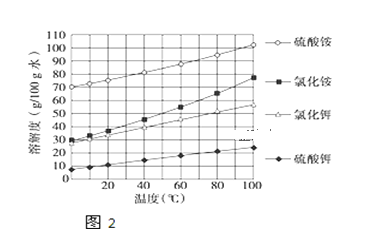
(4)进一步提纯产品Ⅱ的方法是;__________________
(5)步骤IV反应的离子方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g)。下列不能说明反应一定达到化学平衡状态的是
C(g)+D(g)。下列不能说明反应一定达到化学平衡状态的是
A. v正(B)=2v逆(C) B. 每消耗1molC,同时生成1molD
C. 气体的密度保持不变 D. 容器内压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镍、铂、镧等过渡金属单质及化合物在医疗等领域有广泛的应用。
(1)基态镍原子的价电子排布式为__________。
(2)抗癌药奥钞利铂(又名乙二酸铂)的结构简武如图所示。
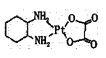
①分子中氮原子杂化轨道类型是______,C、N、O三种元素的第一电离能由大到小的顺序为________。
②1mol乙二酸分子中含有σ键的数目为_____NA。
(3)碳酸澜[La2(CO3)3]可用于治疔高磷血症。
①写出与CO32-互为等电子体的一种分子的化学式________。
②镧镍合金可用于储氢,储氢后晶体的化学式为LaNi5(H2)3,最小重复结构单元如图所示(![]() 、O、●代表晶体中的三种微粒),则图中●代表的微粒是_______(填微粒符号)。
、O、●代表晶体中的三种微粒),则图中●代表的微粒是_______(填微粒符号)。

(4)用还原铁粉制备二茂铁开辟了金属有机化合物研究的新领域。二茂铁甲酰胺是其中一种重要的衍生物,结构如图所示。
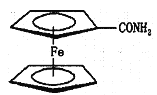
①巳知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁平酰胺晶体为______晶体。
②二茂铁甲酰胺中存在的化学键_________。
③碳氮元素对应的最简单氢化物分别是CH4和NH3,相同条件下NH3的沸点比CH4的沸点高,主要原因是______________。
(5)铝镍合金的晶胞如图所示。已知:铝镍合金的密度为ρg/cm3,NA代表阿伏加德罗常数,则晶胞中镍、铝原子的最短核间距(d)为_______pm。
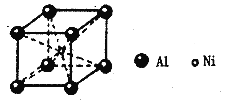
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知: SOCl2+H2O![]() SO2↑+2HCl↑,下列说法不正确的是
SO2↑+2HCl↑,下列说法不正确的是
A. “酸浸” 时应该用盐酸溶解硅孔雀石粉
B. “氧化”时发生反应的离子方程式为:Cl2+2Fe2+![]() 2Fe3++2Cl-
2Fe3++2Cl-
C. “调pH”时,pH需控制在碱性区域,保证铁元素全部以Fe(OH)3形式除去
D. “加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定体积 CaCl2 和 HCl 的混合溶液中逐滴加入浓度为 1.00mol·L-1的 Na2CO3溶液,反应过程中加入的 Na2CO3 溶液的体积与产生沉淀或气体的质量关系如图所示。
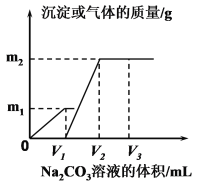
已知:图中 V1 :V2=1:2,当加入 V2mL Na2CO3溶液时,所得溶液的浓度为 1.00 mol·L-1,体积为 200mL。求:
(1)混合溶液中 CaCl2和 HCl 物质的量之比n(CaCl2)∶n(HCl)=_______(2)m2=______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究弱电解质的电离,有重要的实际意义。
Ⅰ. 醋酸是一种常见的有机酸。
(1)醋酸的电离方程式为__________________________________________________。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是________。
A. c(CH3COO-) B. c(H+)
C. c(OH-) D. CH3COOH电离平衡常数
(3)向0.1 mol·L-1 CH3COOH溶液中加水稀释,c(CH3COO-) / c(CH3COOH)的比值将________(填“变大”、“不变”或“变小”)。
(4)下列事实一定能说明CH3COOH是弱电解质的是____________(填字母)。
A. 相同温度下,浓度均为1 mol·L-1的盐酸和醋酸的导电性对比:盐酸>醋酸
B. 1 mol·L-1 CH3COOH溶液能使紫色石蕊试液变红
C. 25℃时,1 mol·L-1 CH3COOH溶液的pH约为2
D. 10 mL 1mol·L-1的CH3COOH溶液恰好与10 mL 1mol·L-1 NaOH溶液完全反应
Ⅱ. 对比酸性的相对强弱
(5)现有a. CH3COOH b. HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
① 将pH相同的两种酸溶液分别稀释100倍后,pH的大小关系为a_______b。
② pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a_______b。
③ 将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a_______b。
④ 相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a_______b。
(6)某些弱酸的电离常数如下:
化学式 | CH3COOH | HSCN | HCN | HClO | H2CO3 |
电 离 常 数 | 1.8×10-5 | 1.3×10-1 | 4.9×10-10 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
①下列反应可以发生的是__________(填字母)。
A. CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
②25℃时,将20 mL 1 mol·L-1 CH3COOH溶液和20 mL 1 mol·L-1 HSCN溶液分别与20 mL1 mol·L-1 NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式。__________
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com