
除去NaCl溶液中MgC12、CaC12的方法是( )
A. 将样品溶于蒸馏水,加入过量NaOH过滤后,加盐酸蒸发
B. 将样品溶于蒸馏水,加入过量 Na2CO3过滤后,加盐酸蒸发
C. 将样品溶于蒸馏水,加入过量Ca(OH)2过滤,然后加过量Na2CO3过滤,在滤液中加过量盐酸后蒸发
D. 用半透膜有选择地除去Ca2+、Mg2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
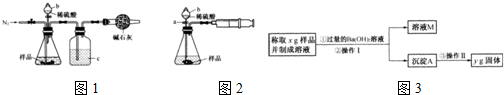
 欲用含有少量氯化钙的氯化钠固体,配制100mL 1mol/L的氯化钠溶液,设计了下面的操作方案.根据方案操作步骤回答下列问题:
欲用含有少量氯化钙的氯化钠固体,配制100mL 1mol/L的氯化钠溶液,设计了下面的操作方案.根据方案操作步骤回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 106y |
| 197x |
| 106y |
| 197x |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
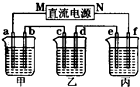 目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)| 电极 | a | b | c | d | e | f |
| 石墨 | 石墨 | 铜 | 钢 | 钢 | 铜 | |
| 溶液 | NaCl溶液 | CuSO4溶液 | CuSO4溶液 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
A.基态原子中不一定都有未成对的电子
B.由极性键形成的分子一定是极性分子
C.晶格能大小顺序:NaCl > KCl
D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子
E.在CaO和SiO2晶体中,都不存在单个小分子
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的基态电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com