
分析 Ⅰ.(1)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$结合1个磷酸分子中含有3个H,1个P,4个O计算解答;依据消耗氢氧化钠物质的判断磷酸种类;
(2)依据n=$\frac{m}{M}$计算,摩尔质量以g/mol为单位数值上等于物质的相对分子质量;
Ⅱ.由(1)可知为无色溶液,则一定不含CuSO4,白色沉淀可能为碳酸钙或硫酸钡;
由(2)可知白色沉淀溶液稀硝酸,则白色沉淀只能为碳酸钙;
由(3)可知,白色沉淀为硫酸钡,则原溶液中一定含Na2SO4,以此来解答.
Ⅲ.(1)发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,根据方程式计算;
(2)计算6片小苏打可以中和氢离子物质的量,再根据Al(OH)3+3HCl=AlCl3+3H2O计算氢氧化铝物质的量,进而计算氢氧化铝的质量,据此计算解答;
(3)加入盐酸生成二氧化碳,可知该药物为铝和镁的碱式碳酸盐,反应过程为:先发生H++OH-═H2O,再发生CO32-+H+═HCO3-,最后发生HCO3-+H+═CO2↑+H2O,从42.5mL~45.0mL消耗2.5mL盐酸,发生反应HCO3-+H+═CO2↑+H2O,根据方程式计算n(HCO3-)、n(CO32-),进而计算HCO3-、CO32-消耗的氢离子物质的量,进而计算n(OH-),据此解答.
解答 解:I.(1)n(H3PO4)=$\frac{4.9g}{98g/mol}$=0.05mol,含有氢原子物质的量为:0.05mol×3=0.15mol,含有O个数为:0.05mol×4×NA=0.2NA,含P元素质量为:0.05mol×31g/mol=1.55g;
6gNaOH物质的量为$\frac{6g}{40g/mol}$=0.15mol,为磷酸物质的量的三倍,所以磷酸为三元酸;
故答案为:0.05mol,0.15,0.2NA,1.55g,三;
(2)因某二价金属的氯化物ACl2中含有0.4molCl-可知,氯化物ACl2的物质的量为$\frac{0.4mol}{2}$=0.2mol,则M(ACl2)=$\frac{m}{n}$=$\frac{19g}{0.2mol}$=95g/mol,所以ACl2相对分子质量为95,则A的相对原子质量为95-35.5×2=24,A为镁;
故答案为:95g/mol;Mg;
II.由(1)可知为无色溶液,则一定不含CuSO4,白色沉淀可能为碳酸钙或硫酸钡;
由(2)可知白色沉淀溶液稀硝酸,则白色沉淀只能为碳酸钙;
由(3)可知,白色沉淀为硫酸钡,则原溶液中一定含Na2SO4,结合(2)中白色沉淀可能一定不含BaCl2,不能确定 KNO3,
综上所述,该白色固体中一定含有CaCO3、Na2SO4,一定不含有CuSO4、BaCl2,可能含有 KNO3,
故答案为:CaCO3、Na2SO4,CuSO4、BaCl2,KNO3;
III.(1)2片小苏打片中含有碳酸氢钠的质量为:0.504g×2=1.008g,
设被中和的HCl物质的量为n(HCl),则:
NaHCO3 +HCl=NaCl+H2O+CO2↑
84g 1mol
1.008g n(HCl)
n(HCl)=$\frac{1mol×1.008g}{84g/mol}$≈0.012mol,
则n(H+)=n(HCl)=0.012mol,
故答案为:0.012;
(2)氢氧化铝与盐酸反应生成氯化铝和水,离子方程式:Al(OH)3+3H+=Al3++3H2O;
6片小苏打可以中和氢离子物质的量=0.012mol×$\frac{6}{2}$=0.036mol,即可以中和HCl为0.036mol,
Al(OH)3+3HCl=AlCl3+3H2O
1 3
x 0.036mol
x=0.012mol
故氢氧化铝质量=0.012mol×78g/mol=0.936g,片小苏打片相当于胃舒平的片数为:$\frac{0.936g}{0.234g}$=4片;
故答案为:Al(OH)3+3H+=Al3++3H2O,4;
(3)加入盐酸生成二氧化碳,可知该药物为铝和镁的碱式碳酸盐,反应过程为:先发生H++OH-═H2O,再发生CO32-+H+═HCO3-,最后发生HCO3-+H+═CO2↑+H2O,
从42.5mL~45.0mL消耗2.5mL盐酸,其物质的量=0.0025L×2mol/L=0.005mol,则:
HCO3-+H+═CO2↑+H2O,
0.005mol 0.005mol
CO32-+H+═HCO3-
0.005mol 0.005mol 0.005mol
故与氢氧根反应的氢离子的物质的量=0.045L×2mol/L-0.005mol-0.005mol=0.08mol,则:
H++OH-═H2O
0.08mol 0.08mol
故该碱式盐样品中氢氧根与碳酸根的物质的量之比=0.08mol:0.005mol=16:1,
故答案为:16:1.
点评 本题为综合题,考查了物质的量有关计算、无机物的推断、方程式有关计算,明确以物质的量为核心计算公式,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与推断能力的考查,题目难度中等.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7 | |
| B. | 同体积、同密度的C2H4和CO,两种气体的分子数一定相等 | |
| C. | 配制450ml0.1mol•L-1的NaOH溶液,用托盘天平称取NaOH固体1.8g | |
| D. | 1L0.45mol•L-1NaCl溶液中Cl-的物质的量浓度比0.1L0.15mol•L-1AlCl3溶液大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
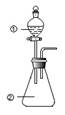 向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ① | ② | 现象 |
| A | 浓盐酸 | 二氧化锰 | 产生黄绿色气体 |
| B | 氯化铁溶液 | 铁氰化钾溶液 | 产生蓝色沉淀 |
| C | 浓硝酸 | 用砂纸打磨过的铝条 | 无明显现象 |
| D | 偏铝酸钠 | 稀盐酸 | 立即产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4LCCl4含有的分子数为NA | |
| B. | 44gCO2的体积为22.4L | |
| C. | 常温常压下,2NA个H2O分子完全电解,生成O2的体积为22.4L | |
| D. | 标准状况下,33.6LCl2含有1.5个Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均增大 | B. | 均不变 | C. | ①增大,②不变 | D. | ①减小,②不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 配制CuSO4溶液 | 将硫酸铜晶体溶于热水中,然后稀释 |
| B | 除去试管内壁的银镜 | 加入浓氨水浸泡,再用蒸馏水洗涤 |
| C | 提纯含少量乙酸的乙醇(乙醇沸点78.5℃) | 加入生石灰后进行蒸馏,收集78.5℃馏分 |
| D | 证明HClO为弱酸 | 用洁净的玻璃棒蘸取NaClO溶液在pH试纸上,待试纸变色后与标准比色对照 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,X 的转化率为50% | |
| B. | 该握度下平衡常数K=10(10mol•L-1)-1 | |
| C. | 10min内生成物Z 的反应速率0.02mol•L-1•min-1 | |
| D. | 若Y是有色气体,只压缩容器的体积,则体系颜色变浅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com