
����Ŀ����Zn(��Ҫ����Fe��Al��Pb����)����������ȡH2�����������Һ�Ʊ�����п����(ZnSO4��7H2O)��Al2O3��Fe2O3������������

��֪Al3����Fe3����Zn2��������������ȫ������pH�ֱ�Ϊ5.2��4.1��8.5��ZnSO4��7H2O����������ˮ���绯���ش�����������
(1)����pH��2��Ŀ����______________________������pH��2���ɼ���________________(�ѧʽ)��
(2)д�����ɳ���3�Ļ�ѧ����ʽ��_____________________________________��
(3)����Ũ��ZnSO4��Һ���ּ�����Ĥʱ��Ҫֹͣ���ȵ���Ҫԭ����_______________________________��
(4)
ijͬѧ����ͼ��ʾ��װ�ó�����

���йس��˵�˵����ȷ����________(����ĸ)��
A�����˵�Ŀ����Ҫ�ǵõ��ϸ���ij���
B����ֽ��ֱ��Ӧ��С��©���ھ������ܸ�סȫ��С��
C��ͼ����һ������
D�����˽�����������ƿ��֧�ܿڵ�����Һ
��������ϴ�ӳ����ľ��������____________________________________________________��
(5)Ϊ�õ������ZnSO4��7H2O��Ʒ��ѡ����﷽����________(����ĸ)��
A�����Ⱥ��
B����ŨH2SO4����
C���þƾ�ϴ��
D���ڿ�������Ȼ����
���𰸡� ����Zn2��ˮ�⣬Zn2����2H2O![]() Zn(OH)2��2H�� H2SO4 NaHCO3��NaAlO2��H2O===Al(OH)3����Na2CO3 ��ֹʧȥ�ᾧˮ B �ȹ�Сˮ��ͷ������ϴ�Ӽ����������ʹϴ�Ӽ�����ͨ�������� C
Zn(OH)2��2H�� H2SO4 NaHCO3��NaAlO2��H2O===Al(OH)3����Na2CO3 ��ֹʧȥ�ᾧˮ B �ȹ�Сˮ��ͷ������ϴ�Ӽ����������ʹϴ�Ӽ�����ͨ�������� C
��������(1)����pH��5.2ʱ����������Ҫ�ɷ���Al(OH)3��Fe(OH)3����Һ�к���ZnSO4 ��������ҺpH��2��������ZnSO4ˮ�⣬��ֹ����Zn(OH)2��ͬʱΪ�˱����������ʣ�Ӧ��ʹ��H2SO4��(2)����Al(OH)3��Fe(OH)3��NaOH����������NaAlO2��Fe(OH)3���μӷ�Ӧ�����˺���Һ�к���NaAlO2��NaOH������NaHCO3��Ӧ���ɵij�����Al(OH)3����ѧ����ʽ��NaHCO3��NaAlO2��H2O===Al(OH)3����Na2CO3��(3)����ZnSO4��7H2O�����绯������Ũ��ZnSO4��Һʱ���ᾧ�õ��ľ������ֽ�ʧȥ�ᾧˮ��(4)�ٳ������ڹ��ˣ��������ٶȱȽϿ죬���ҹ��˽ϳ��ף�ѡ��A����Ϊ�˷�ֹ��ֽ��Ե���������©�������ȫ���ϣ����Գ��˵���ֽҪ��С��©���ھ������DZ����ס����С�ף�ѡ��B��ȷ��ԭװ��ͼ�а�ȫƿ��������ƿ�ĵ��ܲ������밲ȫƿ��̫��������©���¶�б��Ӧ�Գ����죬ѡ��C����ʵ���������Һ������ƿ�Ͽڵ�����ѡ��D����ѡB����ϴ�ӳ���ʱ���ȵ�С������ѹ����ڳ���©���м���ˮ��û��������(5)ZnSO4��7H2O�����绯�����Ⱥ�ɻᵼ�¾���ʧȥ�ᾧˮ��A����Ũ�������ǿ�ҵ���ˮ�ԣ���Ũ�������Ҳ��ʹ����ʧȥ�ᾧˮ��B���ƾ��ܹ��ܽ�ˮ�������ᵼ�¾���ʧȥ�ᾧˮ��ϴ�Ӻ�ƾ������¾ͺ����ӷ���C��ȷ����������Ȼ����Ҳ��绯��D����ѡC��


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú������Һ�����ִ���Դ��ҵ���ص㿼�ǵ���Դ�ۺ����÷������������������Ϊ��ú����ˮú��������ǰ�Ƚ����е�Һ������Ϊ��ú����CH3OH����֪�Ʊ��״����йػ�ѧ��Ӧ��ƽ�ⳣ��������
��CO2(g)��3H2(g) ![]() CH3OH(g)��H2O(g) ��H1����90.8 kJ��mol��1
CH3OH(g)��H2O(g) ��H1����90.8 kJ��mol��1
��CO(g)��H2O(g) ![]() CO2(g)��H2(g) ��H2����41.2 kJ��mol��1
CO2(g)��H2(g) ��H2����41.2 kJ��mol��1
��CO(g)��2H2(g) ![]() CH3OH(g)����H3
CH3OH(g)����H3
850 ��ƽ�ⳣ���ֱ�ΪK1��160��K2��243��K3��160���״����������ᷴӦ������CH3OH(l)��CH3COOH(l) ![]() CH3COOCH3(l)��H2O(l)��
CH3COOCH3(l)��H2O(l)��
(1)��Ӧ��H3��____________�������Ϸ�Ӧ��K�ı���ʽ________________��
(2)��CO�ϳɼ״�ʱ�������йظ÷�Ӧ��˵����ȷ����________(����ĸ)��
A���������������������������ڵ�ѹǿ�������仯������淴Ӧ�ﵽƽ��
B��һ����������H2 ������������CO���������ʵ�2��ʱ�����淴Ӧ�ﵽƽ��
C��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䲢���CH3OH �IJ���
D��ij�¶�������2 mol CO��6 mol H2 ����2 L�ܱ�����������ַ�Ӧ���ﵽƽ��������c(CO)��0.2 mol��L��1����CO��ת����Ϊ80%
(3)850 ��ʱ�����ܱ������н��з�Ӧ������ʼʱֻ����CO2��H2����Ӧ10 min���ø���ֵ�Ũ�����±����Ƚ������淴Ӧ�����ʵĴ�С��v��________(����������������������)v������ʱ����ڷ�Ӧ����v(H2)��____________________________________________________��
���� | H2 | CO2 | CH3OH | H2O |
Ũ��/mol��L��1 | 0.2 | 0.2 | 0.4 | 0.4 |
(4)��һ��������3 L�����ܱ�������������һ������H2��CO2��������Ӧ����ʵ���÷�Ӧ���ڲ�ͬ��ʼͶ����������Ӧ��ϵ��CO2��ƽ��ת�������¶ȵĹ�ϵ��������ͼ1��ʾ��
![]()

��H2��CO2����ʼ��Ͷ������A��B���ַ�ʽͶ��
A��n(H2)��3 mol��n(CO2)��1.5 mol��
B��n(H2)��3 mol��n(CO2)��2 mol����������������Ͷ�뷽ʽ________(��A��B��ʾ)��
�����¶�Ϊ500 K��������������A��ʽ����3 mol H2��1.5 mol CO2���÷�Ӧ10 minʱ�ﵽƽ�����ڴ���������ϵͳ��CH3OH��Ũ���淴Ӧʱ��ı仯������ͼ2��ʾ������Ӧʱ��ﵽ3 minʱ��Ѹ�ٽ���ϵ�¶�����600 K������ͼ2�л���3��10 min��������CH3OHŨ�ȵı仯����������_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���飨33As����Ԫ�����ڱ����뵪����ͬ���壬������Ȼ����ڵ���Ҫ����������˪��As2O3�����ۻ�( As4S4�����ƻƣ�As2S3���ȡ�
��1������Ԫ�����ڱ��е�λ��Ϊ________��
��2����һ�������£��ۻ�(As4S4���ۻ���AsԪ�ػ��ϼ�Ϊ+2���ʹƻ�As2S3֮���ת����ϵ��ͼ��ʾ��

��H3AsO3����Ԫ�س�_______�ۣ�����ת����ϵI�У�����ԭ��Ԫ��������____________��
����Ӧ���У���1mol As4S4�μӷ�Ӧʱ��ת��12mole-��������aΪ______���ѧʽ������As2O3���׳���˪���ڸ������ý�̿��ԭ���Ʊ��飬ͬʱ����һ����������д���ý�̿��ԭAs2O3ʱ�Ļ�ѧ����ʽ��_________��
����ת����ϵ���У���As2O3������ˮ������������H3AsO3������֪H3AsO3������ƫ���ԵĻ����Na3AsO3��Һ�ʼ��ԣ�ԭ����_________����ˮ�����ӷ���ʽ��ʾ����
��3��ijԭ���װ����ͼ������ܷ�ӦΪAsO43-+2I-+H2O![]() AsO32-+I2+OH-����P������Һ����ɫ�����ɫʱ�������ϵĵ缫��ӦʽΪ___________��
AsO32-+I2+OH-����P������Һ����ɫ�����ɫʱ�������ϵĵ缫��ӦʽΪ___________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ������ȷ���ǣ� ��
A. �Ҵ����Ҷ�������������Ϊͬϵ�ͬϵ��֮�䲻����Ϊͬ���칹��
B. 1 mol�ǻ�(-OH)�����ĵ�����ԼΪ10��6.02��1023
C. 14g����ʽΪCnH2n�������к��е�C=C����Ŀһ��Ϊ1/nNA
D. ![]() ����������ģ��
����������ģ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������Mg��Al�Ļ����Ͷ��500 mLϡ�����У�����ȫ���ܽⲢ�������塣����Ӧ��ȫ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ����ͼ��ʾ��������˵����ȷ����( )

A��Mg��Al��������Ϊ8 g
B��ԭϡ������Һ�����ʵ���Ũ��Ϊ5 mol��L��1
C�����ɵ�H2�ڱ�״���µ����Ϊ11.2 L
D��NaOH��Һ�����ʵ���Ũ��Ϊ5 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��������ʼ���Ӧ��;��˵����ȷ����(����)
A. ����Ũ�������ˮ�ԣ���������
B. ����þ�۵�ߣ������������ͻ����
C. ̼������Һ�ʼ��ԣ�����������θ�����
D. �������費���κ��ᷴӦ������ʯӢ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��Ӧ��Ӧ��ͼ����ȷ����

A��25��ʱ������������Һ��ͨ������ B����Na[Al��OH��4]��Һ��ͨ�� HCl����
C���������Ȼ�����Һ�м������� D����BaSO4������Һ�м���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������۵�660������һ��Ӧ�ù㷺�Ľ�������ҵ����A12O3���۵�2045�����ͱ���ʯ��Na2AlF6�������������ƣ�������ں����Ƶá��ش��������⣺
(l�������ڻ��ý���ȴ���ڿ������ȶ����ڣ�ԭ���ǣ��û�ѧ���P�������˵����_______.
(2����0.1 mol/L AlCl3��Һ��10��NH4F��Һ�����ȡNa2AlF6����ʵ�������Թܼ�ʢװNaF ��Һ���Լ�ƿ��Ϊ���ϲ��ʣ�ԭ����____________��
(3�����й�����������������ȷ����_______
A����������������θ����ࡣ
B����������Ϊ�۵�ߣ��������ͻ���ϣ�
C�������������ȼ��ijɷ�֮һ��
D����������������������Լ������������������ڰ�ˮ��
(4��ij�����ŷų��ж�����NOCl , ����ˮ�ͻ�����NO3-��NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ����NOCl�ĵ���ʽΪ_________��ˮԴ�е�NO3-�����ཡ�������Σ����Ϊ�˽���ˮԴ��NO3-��Ũ�ȣ����о���Ա�����ڼ��������������۽�NO3-��ԭΪN2���÷�Ӧ�����ӷ���ʽΪ_________���˷�����ȱ���Ǵ������ˮ��������A1O3-����Ȼ���ܶ����ཡ������Σ��������Ҫ�Ը�����ˮ����һϵ�к���������
��֪25��ʱ��Ksp[Al(OH)3] = l.3��l0-33 Al(OH)3![]() AlO2-+H++H2O K=1.0��10-13
AlO2-+H++H2O K=1.0��10-13
25��ʱ������ʹ�����������ˮ��A1O2-Ũ�Ƚ���1.0��10-6mol/L����Ӧ������pH=_______��
��ʱˮ��c(A13+��=__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⡿���ܼ����Ѿ���Ϊȫ���Ĺ�ʶ���㽭ʡ��ԭ�������Ҵ����͵Ļ����ϣ���ʼ�Ե�״����ͣ���������������һ�����ļ״��������ݼ������ݷ�����Ϊ��������ȫ�е�100������������ȫ��ʹ�ü״����ͣ�һ�����ܼ����к����壨һ����̼���ŷŽ���100��֡��״�������ú�������������ɵ�CO��H2���Ʊ���CO+2H2CH3OH ��
�����ͼʾ�ش����У�
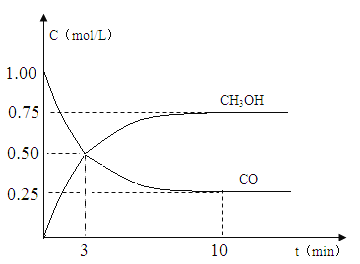
��1�����ڸ��Է���Ӧ������˵���У���ȷ���� ������ĸ����
A����H>0����S>0 B����H>0����S<0
C����H<0����S<0 D����H<0����S>0
��2���ֽ�������ʵ�飬�����Ϊ1L���ܱ������У�����1molCO��3molH2�����CO��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ���ӷ�Ӧ��ʼ��ƽ�⣬CO��ƽ����Ӧ����v��CO��= mol/(Lmin)���÷�Ӧ��ƽ�ⳣ��K= ��
��3�����������£��ﵽƽ������д�ʩ����ʹn(CH3OH)/n(CO)������� ��
A�������¶� B������He�� C���ٳ���1molCO��3molH2 D��ʹ�ô���
��4������һ����ɱ���ܱ������г���1molCO��2molH2��1molCH3OH���ﵽƽ��ʱ��Ļ��������ܶ���ͬ��ͬѹ����ʼ��1.6�����˹����������ʾ�������̬������ƽ��ʱ��������ƽ��Ħ������= g/mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com