
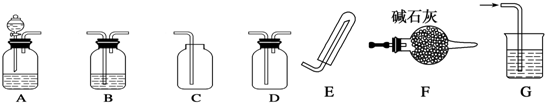
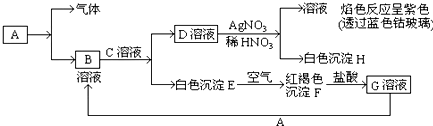
分析 (1)①固体氢氧化钠和浓氨水可以快速制取氨气;
②氧气的密度比空气大;氧气能使带火星的木条复燃;
(2)用强酸制弱酸原理解题.
解答 解:(1)①利用固体氢氧化钠和浓氨水可以快速制取氨气.氨气密度比空气小,所以采用向下排空气法收集,
故答案为:AFE;固体氢氧化钠或氧化钙;
②氧气的密度比空气大,所以采用向上排空气法收集,正确的组合为ABC,检验O2收集满的方法是将带火星的木条靠近集气瓶口,若木条复燃,则说明氧气收集满了,
故答案为:ABC;将带火星的木条靠近集气瓶口,若木条复燃,则说明氧气收集满了;
(2)在利用A、B组合验证盐酸、碳酸、次氯酸的酸性强弱时,可以采用强酸制弱酸的方法,A中利用盐酸和碳酸钠反应制取二氧化碳,盐酸应装入分液漏斗,将二氧化碳通入B中的次氯酸钙中,可反应生成次氯酸和CaCO3 沉淀,反应方程式:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO,
故答案为:分液漏斗;Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO.
点评 本题考查化学实验方案设计,根据气体制备原理、收集和检验方法解题,题目难度不大.


科目:高中化学 来源: 题型:填空题
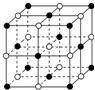 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知: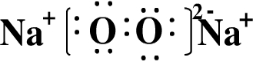 ,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
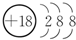 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
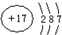 ,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024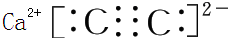
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的能量比G高 | |
| B. | N的能量比G高 | |
| C. | 这一反应不需要加热一定能发生 | |
| D. | 反应物的能量之和大于生成物的能量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=0.5,当Cu2+在阴极恰好全部析出时,产生的气体只有氯气 | |
| B. | 若a=0.5,当Cu2+在阴极恰好全部析出时,产生的气体的物质的量为0.1mol | |
| C. | 若a=0.2,当Cl-在阳极恰好全部逸出时,产生0.08mol的NaOH | |
| D. | 若电解一段时间后,阴、阳两极产生的气体的物质的量恰好均为0.16mol,则a=0.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com