
| A.SO3通入水中:SO3+H2O=H2SO4 |
| B.Cl2通入FeCl2溶液中:Cl2+2FeCl2=2FeCl3 |
| C.HCl通入NaOH溶液中:HCl+NaOH=NaCl+H2O |
| D.CO2通入NaOH溶液中:CO2+2NaOH=Na2CO3+H2O |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2既是氧化剂又是还原剂 |
| B.每有1molCl2参加反应,就有2mol电子转移 |
| C.该反应可用于实验室制Cl2时尾气的吸收 |
| D.该反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaCO3=CaO+CO2↑ | B.NH3+HCl=NH4Cl |
| C.NaOH+HCl=NaCl+H2O | D.Zn+H2SO4(稀)=ZnSO4+H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Zn+H2SO4═ZnSO4+H2↑ | ||||
B.2KClO3
| ||||
C.S+O2
| ||||
D.CH4+2O2
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子半径:Na+>N3->H+ |
| B.反应①和②都是氧化还原反应 |
| C.反应②每生成1molH2,转移的电子数为NA |
| D.Na3N和NaH与盐酸反应都只生成一种盐 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
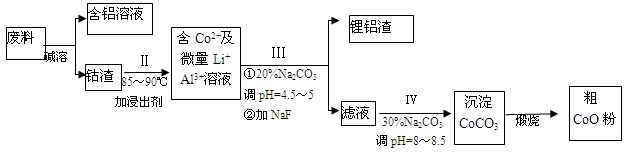
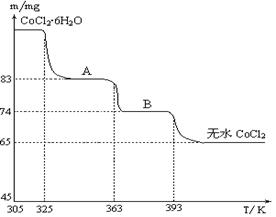
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com