
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率为v(PCl3)=0.0016mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80% |
分析 A、由表中数据可知50s内,△n(PCl3)=0.16mol,根据公示计算v(PCl3);
B、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.22mol,根据平衡时n(PCl3),判断平衡移动方向,升高温度平衡向吸热反应方向移动;
C、先求平衡常数K,再求浓度商(Qc),K>Qc,说明平衡向正反应方向移动,K<Qc,说明平衡向逆反应方向移动,K=Qc,说明平衡不移动,据此判断平衡移动;
D、等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl3的转化率较原平衡高.
解答 解:A、由表中数据可知50s内,△n(PCl3)=0.16mol,其浓度是0.16mol÷2L=0.08mol/L,所以v(PCl3)=0.08mol/L÷50s=0.0016mol/(L•s),故A正确;B、由表中数据可知,平衡时c(PCl3)=0.2mol÷2L=0.1mol/L,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,说明升高温度平衡正向移动,正反应为吸热反应,即△H>O,故B正确;
C、对于可逆反应:
PCl5(g)?PCl3(g)+Cl2(g)
起始浓度(mol/L) 0.5 0 0
转化浓度(mol/L) 0.1 0.1 0.1
平衡浓度(mol/L) 0.4 0.1 0.1
所以平衡常数K=$\frac{0.1×0.1}{0.4}$=0.25.起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度Qc=$\frac{0.2×0.2}{1}$=4,K>Qc,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C正确;
D、等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,故达到平衡时,PCl3的转化率高于$\frac{1.6mol}{2mol}$×100%=80%,故D错误,
故选D.
点评 本题考查反应速率、平衡常数计算、平衡移动、等效平衡等,难度中等,注意D中使用等效平衡思想分析,使问题简单化,也可以根据平衡常数计算,但比较计算比较复杂.


科目:高中化学 来源: 题型:选择题
| A. | 丙烯 | B. | 1,3-丁二烯 | C. | 丙炔 | D. | 2-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L | B. | 0.15 mol/L | C. | 0.25 mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
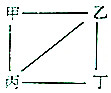 X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )
X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最大 | |
| D. | W的最高化合价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡 常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | 将0.1mol/L的醋酸加水不断稀释,c(CH3COO-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离予方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等浓度的CH3COOH、HClO、H2CO3和H2SO3溶液中,酸性最强的是HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Mg | Al | S | Cl | Ar |
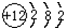 ,其对应的元素符号是Mg;
,其对应的元素符号是Mg;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素组成的化合物中只可能含有共价键 | |
| B. | VIIA族元素气态氢化物的热稳定性从上到下依次减弱 | |
| C. | 第二周期元素原子的半径从左到右依次增大 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2中含有的阴离子数为0.2NA | |
| B. | 铜与浓硫酸反应中,当转移的电子数为0.2NA时,生成的SO2为2.24 L | |
| C. | 1 mol•L-1的NH4Cl溶液中的NH4+的数目小于NA | |
| D. | 由NO2、O2组成的混合物中共有NA个分子,其中的氧原子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com