
 价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:
价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:| 等电子体类型 | 代表物质 | 空间构型 |
| 四原子24电子等电子体 | SO3 | 平面三角形 |
| 四原子26电子等电子体 | SO32- | 三角锥形 |
| 五原子32电子等电子体 | CCl4 | 四面体形 |
| 六原子40电子等电子体 | PCl5 | 三角双锥 |
| 七原子48电子等电子体 | SF6 | 八面体形 |
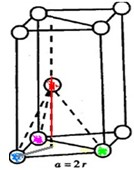 根据上述信息,回答下列问题:
根据上述信息,回答下列问题:| m |
| V |
| ||
| 2 |
| ||
| 3 |
2
| ||
| 3 |
| ||
| 2 |
2
| ||
| 3 |
| 2 |
| 2 |
| 1 |
| 8 |
| m |
| V |
| ||
8
|
| 3 |
| ||||
| 3 |
| ||||


科目:高中化学 来源: 题型:
(8分)有①质子数②中子数③核外电子数④价电子数⑤最外层电子数⑥电子层数。请用上述序号回答:
(1)原子种类由 决定,元素种类由 决定。
(2)原子的质量数由 决定,元素在周期表中的位置由 决定。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江海林市高级中学高一下学期期中考试化学试卷 (带解析) 题型:填空题
(8分)有①质子数②中子数③核外电子数④价电子数⑤最外层电子数⑥电子层数。请用上述序号回答:
(1)原子种类由 决定,元素种类由 决定。
(2)原子的质量数由 决定,元素在周期表中的位置由 决定。
查看答案和解析>>
科目:高中化学 来源:2014届黑龙江海林市高一下学期期中考试化学试卷(解析版) 题型:填空题
(8分)有①质子数②中子数③核外电子数④价电子数⑤最外层电子数⑥电子层数。请用上述序号回答:
(1)原子种类由 决定,元素种类由 决定。
(2)原子的质量数由 决定,元素在周期表中的位置由 决定。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com