
| |||||||||||||||||||||||||
科目:高中化学 来源:2007高三化学高考冲刺模拟(13) 题型:022
| |||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题

查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
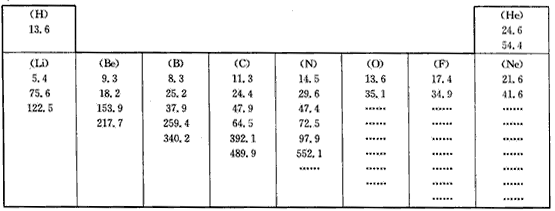
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上十二种元素分别属于s区、d区和ds区,则属于s区的元素有 种,属于d区的元素有 种。
(3)试比较:第一电离能I1(Cr) I1(Co)(填“>”、“<”或“=”,下同);
晶格能U(FeO) U(NaCl)(FeO与NaCl的晶胞结构相似)。
(4)钇钡铜氧是一种新型节能高温超导体,其晶胞结构如下图所示,研究发现,此高温超导体中的Cu元素有两种价态,分别为+2价和+3价,Y元素的化合价为+3价,Ba元素的化合价为+2价。

①该物质的化学式为: 。
②该物质中Cu2+与Cu3+的原子个数比为: 。
(5)现有一种含钛的晶体,其组成为TiCl3?6H2O,晶体中Ti3+的配位数为6。为测定该晶体的化学式,进行了如下实验:取一定质量的该晶体(含0.01molTi3+)配成溶液,向其中滴入足量AgNO3溶液,产生白色沉淀,沉淀完全后过滤,经洗涤干燥后称量,质量为2.87g。试推断紫色晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
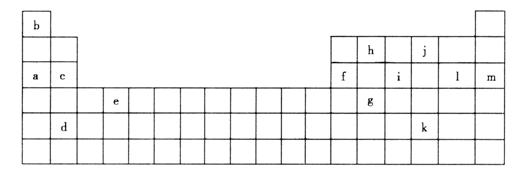
(1)下列__________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外`
电子离开该原子或离子所需要的能量主要受两大因素的影响:
a.原子核对核外电子的吸引力 b.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1)
| 锂 | X | Y |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7296 | 4570 | 1820 |
失去第三个电子 | 11799 | 6920 | 2750 |
失去第四个电子 |
| 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量远远大于失去第一个电子所需的量____________________。
②表中X可能为以上13种元素中的__________(填写字母)元素。用元素符号表示X和j形成化合物的化学式____________________。
③Y是周期表中__________族元素。
④以上13种元素中__________(填字母)元素原子失去核外第一个电子需要的量最多。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com