
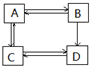
| A. | A的相对分子质量小于C、D的相对分子质量而大于B的相对分子质量 | |
| B. | 若A为2-丙醇,则其可实现如右图的所有转化 | |
| C. | 若A、B、D、为链状化合物,则C也一定为链状化合物 | |
| D. | C→A的反应类型为加成反应 |
分析 A、B、C、D为中学化学中常见的烃的含氧衍生物,根据图中转化关系可知,应为醇、醛、羧酸、酯之间的相互转化,醇氧化生成醛,与羧酸反应得到酯;醛氧化生成羧酸,与氢气发生加成反应得到醇;羧酸与醇反应生成酯,酯水解得到醇与羧酸,一般情况下羧酸与酯不能与氢气发生加成反应,由转化关系可知,B反应生成D,而D不能反应生成B,其它物质之间的转化可以双向进行,故B与D之间的转化为醛生成羧酸,可推知B为醛、C为酯,故A为醇、D为羧酸,据此答题.
解答 解:A、B、C、D为中学化学中常见的烃的含氧衍生物,根据图中转化关系可知,应为醇、醛、羧酸、酯之间的相互转化,醇氧化生成醛,与羧酸反应得到酯;醛氧化生成羧酸,与氢气发生加成反应得到醇;羧酸与醇反应生成酯,酯水解得到醇与羧酸,一般情况下羧酸与酯不能与氢气发生加成反应,由转化关系可知,B反应生成D,而D不能反应生成B,其它物质之间的转化可以双向进行,故B与D之间的转化为醛生成羧酸,可推知B为醛、C为酯,故A为醇、D为羧酸,
A.A为醇,C为酯,D为羧酸,根据转化关系,它们中的碳原子数相同,所以A的相对分子质量小于C、D的相对分子质量而大于B的相对分子质量,如A为乙醇、B为乙醛、C为乙酸乙酯、D为乙酸,乙醇的相对分子质量小于乙酸乙酯、乙酸的相对分子质量而大于乙醛的相对分子质量,故A正确;
B.若A为2-丙醇,则B为丙酮,丙酮不能氧化成羧酸,不能实现如右图的所有转化,故B错误;
C.若A、B、D分别为链状二元醇、醛、羧酸,则C也可以环状酯,故C错误;
D.C→A的反应类型为酯的水解生成醇,是取代反应,故D错误;
故选A.
点评 本题考查有机物的推断,熟练掌握官能团的性质与相互转化是解答关键,注意理解掌握高频考点醇、醛、羧醛、酯之间的相互转化,题目难度中等.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | 金属性:B>A,非金属性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
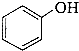
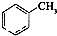
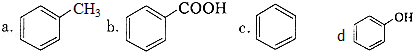
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
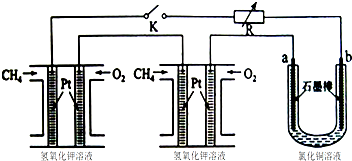
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
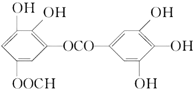 某有机物的结构简式是(如图),下列关于它的性质叙述正确的是( )
某有机物的结构简式是(如图),下列关于它的性质叙述正确的是( )| A. | ①②③ | B. | ②③⑤ | C. | ⑥ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com