
【题目】异丁烷、乙醇硫酸氢钾、液氮均可做制冷剂,下列关于它们的相关表示正确的是( )
A.异丁烷的结构简式为:(CH3)3CH
B.乙醇的比例模型为:![]()
C.熔融KHSO4的电离方程式:KHSO4→K++H++SO42-
D.氮原子核外电子的轨道表示式:![]()
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】在实验室里,常用如图所示装置制取并收集氨气。请回答下列问题:
(1)原理与方法
①制取氨气的化学方程式为__________________________________;
②该收集氨气的方法为________。
A.向上排空气法 B.向下排空气法
(2)装置与操作
按下图组装仪器,进行实验。仪器a的名称为____________。

(3)思考与交流
①欲制取标准状况下4.48 L NH3,至少需要NH4Cl________g;
②实验室制取氨气,还可采用下图中的______(填“A”或“B”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
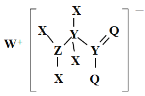
A.Z的最高价氧化物对应的水化物是一元强酸
B.WX的水溶液呈中性
C.元素非金属性的顺序为Y>Z>Q
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同分异构体的是
A. O2和O3
B. CH3CH3和CH2=CH2
C. ![]() 和
和
D. CH3CH2CH2CH2 CH3和(CH3)2CH CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶淡黄色粉末,标签已脱落。某学习小组为确定其成分,进行实验探究。
(提出猜想)淡黄色粉末成分可能是
猜想一:硫黄
猜想二:过氧化钠
(实验步骤)
①按下图组装仪器;
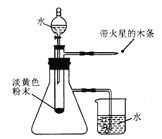
②………
③打开分液漏斗,滴加水;
④用带火星的木条靠近导气管的尖嘴处。
(实验现象)试管中剧烈反应,产生大量气泡;带火星的木条复燃;小烧杯中的导管口有气泡冒出;试管内最终得到无色溶液。
(结论与分析)
(1)实验步骤②迸行的操作是_______;(填字母代号)
A.先加入试剂,后检查装置气密性 B.先检查装置气密性,后加入试剂
(2)根据上述现象分析,猜想________正确;
(3)带火星的木条复燃,说明反应生成的气体是________;
(4)小烧杯中的导管口有气泡冒出,说明淡黄色粉末与水反应是_________(填“放热”或“吸热”)反应;
(5)淡黄色粉末与水反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料的过程。水煤气生产原理为:C(s)+H2O(g)![]() CO(g)+H2(g)-131.3kJ。
CO(g)+H2(g)-131.3kJ。
(1)该反应的平衡常数K的表达式__;温度升高,K值__(填“变大”、“不变”或“变小”)。
(2)一定温度下,在一个容积不变的密闭容器中进行水煤气的生产反应,下列能判断该反应达到化学平衡状态的是__。
A.容器内压强不变 B.容器内气体密度不变
C.v(CO)=v(H2O) D.c(CO)=c(H2)
(3)如反应的容器容积为1.0L,反应时间为5.0min,容器内气体密度增大了0.12g/L,在这段时间内CO的平均反应速率为__。
(4)研究表明:在使用等质量催化剂时,增大催化剂的表面积可提高化学反应速率,为了分别验证温度,催化剂的表面积对化学反应速率的影响规律,至少应该设计__个实验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取水煤气反应C(s)+H2O(g)CO(g)+H2(g),化学平衡常数表示为K=![]() ,有关化学平衡常数说法正确的是( )
,有关化学平衡常数说法正确的是( )
A.由表达式可知c(CO)与c(CO)增大时,K值增大
B.其他条件不变时,温度升高,K值增大
C.化学平衡向右移动,K值增大
D.K值变化,化学平衡一定发生了移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:
(1)该电池的正极材料是________;电池工作时,阳离子向________(填“正极”或“负极”)移动;负极的反应式为__________。
(2)①电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原来制取,化学反应方程式为ZnO+C![]() Zn+CO↑,此法为_____。
Zn+CO↑,此法为_____。
A 电解法 B 热还原法 C 热分解法
(3)可用石墨作电极电解提纯氢氧化钾电解液。电解池内的阳离子交换膜只允许阳离子通过,其工作原理如图所示。
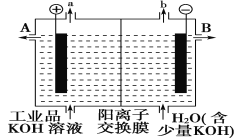
①该电解池的阳极,阴极反应式为阳极:_________阴极:________
②除去杂质后的氢氧化钾溶液从出口________(填“A”或“B”)导出。
③在相同条件下,a处与b处产生的气体体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化情况如图所示。下列说法正确的是( )
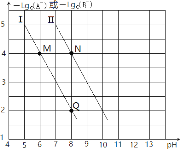
A.曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B.![]() =1000
=1000
C.溶液中水的电离程度:M>N
D.N点对应的溶液中c(Na+)<Q点对应的溶液中c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com