
| A、13C与15N有相同的中子数 |
| B、13C与15N相同的质量数 |
| C、15N与14N互为同位素 |
| D、15N的核外电子数与中子数相同 |


科目:高中化学 来源: 题型:
| A、只有① | B、只有①②④ |
| C、只有②④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中含有0.3 mol的SO42- |
| B、1L溶液中所含Na+、SO42-总数为0.9NA |
| C、溶液中Na+的浓度是0.3 mol/L |
| D、将14.2g Na2SO4溶于100mL水中可配成0.3mol/L Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-
| ||
B、服用阿司匹林过量出现水杨酸(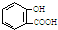 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: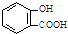 +2HCO3-→ +2HCO3-→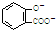 +2CO2↑+2H2O +2CO2↑+2H2O | ||
C、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-
| ||
| D、苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2L N2中所含分子的数目为0.5NA |
| B、在常温常压下,1mol H2中所含原子数目为NA |
| C、71g Cl2中所含原子数目为2NA |
| D、标准状况下,11.2L H2O含有0.5NA个分子. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4、HClO、H2S |
| B、SO2、NH3、CH3COOH |
| C、H2SO4、HNO3、NaOH |
| D、NH3?H2O、H2O、H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaHS溶液中通入Cl2:S2-+Cl2=S↓+2Cl- |
| B、向NaNO2溶液中滴加酸性KMnO4溶液:5NO2-+2MnO4-+3H2O=5NO3-+2Mn2++6OH- |
| C、向NH4HSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O |
| D、向偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不溶于水,且必须易与碘发生化学反应 |
| B、不溶于水,且比水更容易使碘溶解 |
| C、不溶于水,且密度与水密度相差大 |
| D、不溶于水,且密度必须比水小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(K) CO2转化率% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com