
 如图所示是前四周期的五种元素在周期表中的相对位置关系.乙和丁的原子序数之和为甲的4倍,则
如图所示是前四周期的五种元素在周期表中的相对位置关系.乙和丁的原子序数之和为甲的4倍,则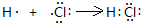 ,
,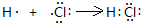 ;
;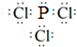 ,故答案为:
,故答案为: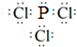 ;
;

科目:高中化学 来源: 题型:
 PPA是一种常用的抗感冒药,但服用该药品能引起头昏、头痛、血压升高,甚至中风、肾功能衰竭等危险.因此,包括我国在内的许多国家已发布了停用含PPA感冒药的通知.已知PPA由四种元素构成,且这四种元素均位于元素周期表的前两周期,结构如图所示,下列有关PPA的说法中正确的是( )
PPA是一种常用的抗感冒药,但服用该药品能引起头昏、头痛、血压升高,甚至中风、肾功能衰竭等危险.因此,包括我国在内的许多国家已发布了停用含PPA感冒药的通知.已知PPA由四种元素构成,且这四种元素均位于元素周期表的前两周期,结构如图所示,下列有关PPA的说法中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
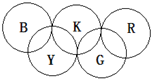 如图所示,形成奥运五环的B、K、R、Y和G均为元素周期表前20号元素的代号,它们还满足下列关系:
如图所示,形成奥运五环的B、K、R、Y和G均为元素周期表前20号元素的代号,它们还满足下列关系:



查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
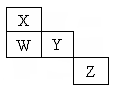 如图为元素周期表前四周期的一部分,W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如表中所示.下列有关叙述中正确的是( )
如图为元素周期表前四周期的一部分,W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如表中所示.下列有关叙述中正确的是( )| A、Z元素一定是金属元素 | B、X、Y、W一定是主族元素 | C、W的氢化物的沸点一定比X的氢化物的沸点高 | D、Z既可能在三周期,也可能在四周期 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com