
下列有关铜锌原电池(如图)的叙述正确的是
| A.正极反应为Zn-2e-=Zn2+ |
| B.电池反应为Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.取下盐桥,原电池仍可工作 |
科目:高中化学 来源: 题型:单选题
某同学按右图所示的装置进行实验,A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,在交换膜处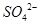 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是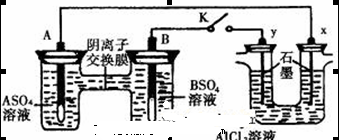
A.B的电极反应:
B.溶液中A2+浓度减小
C.y电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关用惰性电极电解AgNO3溶液的说法不正确的是:
| A.电解过程中阴极质量不断增大 |
| B.电解过程中阳极附近的pH不断降低 |
| C.电解一段时间后,向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况 |
| D.电解过程中,溶液中电子由阴极迁向阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列与金属腐蚀有关的说法正确的是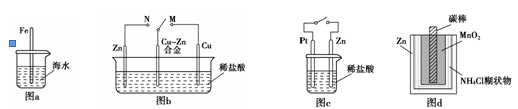
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu?Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验装置中,实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是( ) 
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl— Cl2↑+H2↑ Cl2↑+H2↑ |
| B.断开K2,闭合K1时,电子沿“b →Cu→电解质溶液→石墨→a”的路径流动 |
| C.断开K2,闭合K1时,铜电极附近溶液变红 |
| D.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl— |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是
| A.在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 |
| B.粗铜精炼时,电镀液中的c(Cu2+)保持不变 |
| C.纯银在空气中久置变黑发生的是电化学腐蚀 |
| D.阴极电保护法是将被保护的金属与外加电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
被称为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。总反应的化学方程式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3,下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.电池正极的电极反应式为:2MnO2+H2O+2e-= Mn2O3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实解释准确的是
| A.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。脱氧过程中铁作原电池正极,电极反应为: Fe-2e- = Fe2+ |
| B.酸性氢氧燃料电池的正极电极反应为: 2H2O十O2+4e-=4OH- |
| C.用石墨电极电解CuC12溶液:阳极上发生的反应:2C1-—2e一=C12↑ |
| D.铅蓄电池的正极反应为:PbO2 +4H+ +2e一=Pb2+ +2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图甲池和乙池中的四个电极都是铂电极,乙池溶液分层,上层溶液为盐溶液,呈中性。请根据图示判断下列有关说法正确的是:
| A.甲池的电解池,乙池是原电池 |
| B.通入乙醇的铂电极反应式为C2H5OH+16OH-+12e-=2CO32-+11H2O |
| C.反应一段时间后,两池溶液的pH均未变化 |
| D.假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com