
【题目】下列各组离子在水溶液中能大量共存的是
A.H+、Na+、CO32﹣
B.Ba2+、SO42﹣、Cl﹣
C.K+、H+、OH﹣
D.Ag+、Al3+、NO3﹣
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p | |||||||||||||||
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式:____。
(2)c与a形成6个原子组成分子结构简式:__________,该分子是:_______(填“极性”或“非极性”)分子。
(3)表中O、P两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态P2+再失去一个电子难。对此,你的解释是__________________________;
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
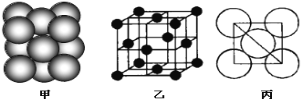
晶胞中i原子的配位数为___________,一个晶胞中i原子的数目为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一混合溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100 mL该溶液进行如下实验:
,现取三份100 mL该溶液进行如下实验:
(1)向第一份溶液中加入AgNO3溶液时有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液并加热后,收集到气体0.06 mol;
(3)向第三份溶液中加入足量BaCl2溶液后,所得沉淀经洗涤、干燥、称量为8.24 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,以下推测正确的是( )
A. K+可能存在 B. 100 mL溶液中含0.01 mol ![]()
C. Cl可能存在 D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
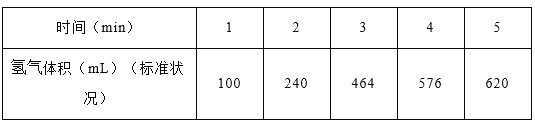
①哪一时间段反应速率最大______min(填0~1、1~2、2~3、3~4、4~5),原因是_____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是____。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
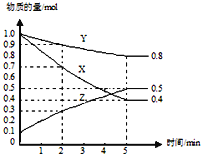
①该反应的化学方程式是_______。
②该反应达到平衡状态的标志是______
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1mol Y的同时消耗2mol Z
③2min内Y的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgI胶体微粒能吸附I-。在10mL0.01mol·L-1KI溶液中,滴入8~10滴(1滴约0.1mL)0.01mol·L-1AgNO3溶液后,将溶液装入半透膜袋中并浸泡在蒸馏水里,过一段时间后,水中含有数目最多的离子是
A.K+B.K+、NO3-C.I-D.Ag+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一。
(l)三氟化氮可由氨气和氟气反应得到: 4NH3+3F2=NF3+3NH4F。NH3的电子式为__________,反应中氨气显示的化学性质有______________,当有17.0 g氨气发生反应时,转移电子的物质的量为_____。
(2)在潮湿的空气中,NF3能与水蒸气发生反应,产物有HF、NO和一种酸,则被氧化与被还原元素原子的物质的量之比为_________,NF3、F2、NO三种气体氧化性由弱到强的顺序为_________。
(3)三氟化氮在空气中泄露时,很易被发现,依据的现象是______________________。
(4)NCl3结构类似NF3,但NCl3中N元素显-3价,NCl3遇水发生反应,目反应为非氧化还原反应,该反应的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。下列有关该工艺的说法错误的是( )
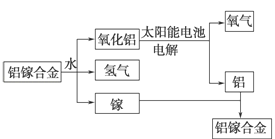
A. 该过程中,能量的转化形式只有两种
B. 铝镓合金可以循环使用
C. 铝镓合金与水反应的化学方程式为:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
D. 总反应式为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+2ICl(g)![]() I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
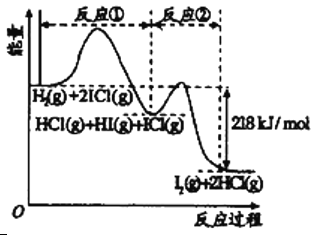
下列有关说法正确的是
A. 反应①为吸热反应
B. 反应①和②均是同种元素间发生的氧化还原反应
C. 反应①比反应②的速率慢,与图中相应峰高有关
D. HI(g)+ICl(g) ![]() I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业上产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉CO2”,其基本过程如图所示(部分条件及物质未标出)
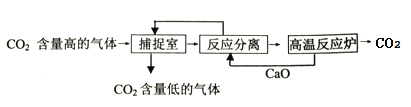
下列有关该方法的叙述中正确的是
A. 能耗小是该方法的一大优点
B. 整个过程中,只有一种物质可以循环利用
C. “反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
D. 该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com