
(8分) (I)已知:在298 K、1.01KPa下,由稳定的单质发生反应生成1 mol气态化合物的反应热叫该化合物的生成热(ΔH).如图所示为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
请你归纳出
(I)非金属元素氢化物的稳定性与其反应热ΔH的关系____________;写出硒化氢在298 K、1.01KPa下,发生分解反应的反应热△H=______ KJ/mol。
(II)已知:拆开1mol Si—Si键,1mol O=O键,1mol Si—O键分别需要的能量是AkJ、BkJ、CkJ,则硅与氧气反应生成1molSiO2的反应热
△H == KJ/mol。
(III)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)
的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。写出该燃料电池的电极反应:
负极: 正极:
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:阅读理解
 飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为:
飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为:
| ||
| 充电 |
| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①碘离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再加入少量NaI饱和溶液, 取PbI2饱和溶液少量于一支试管中,再加入少量NaI饱和溶液, |
溶液中出现黄色浑浊. 原因是溶液中c(I-)增大,使Qc大于了pbI2的Ksp 溶液中出现黄色浑浊. 原因是溶液中c(I-)增大,使Qc大于了pbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 |
黄色浑浊消失 原因是形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于了pbI2的Ksp 黄色浑浊消失 原因是形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于了pbI2的Ksp |
| ③ 铅离子和碘离子浓度都减小对平衡的影响 铅离子和碘离子浓度都减小对平衡的影响 |
在PbI2悬浊液中加入少量FeCl3饱和溶液 | PbI2 +2Fe3++4Cl-=PbCl42-+2Fe2++I2 PbI2 +2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
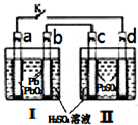
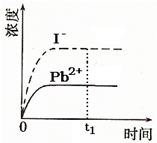 ④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图.
④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷 题型:填空题
(12分)蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
| | 平行测定数据 | 平均值 | |||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
 Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12 Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省资阳市高二下学期期末考试化学试卷(带解析) 题型:实验题
(18分)透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶,制备它的一种配方中含有下列三种物质
甲 乙 丙
(1)下列试剂能与甲反应而褪色的是(填序号) 。
①溴的CCl4溶液 ②酸性KMnO4溶液 ③石蕊试液 ④含酚酞的烧碱溶液 ⑤FeCl3溶液
写出由甲在稀硫酸作用下水解的化学反应方程式:
(2)乙可以由淀粉通过下列转化制得(其中A、B、C、D均为有机物):
i.上述转化过程中涉及的条件X是 。
ii.物质A常用新制Cu(OH)2来检验,其主要的反应原理用化学方程式可表示为:
iii.上述转化过程中属于水解反应类型的有 个。
iv.D是一种液态卤代烃,已知其密度为ρ g/cm3为测定其相对分子质量,拟实验步骤如下:
第一步:准确量取该卤代烃V mL;
第二步:在锥形瓶中加入过量的稀NaOH溶液,塞上连有长玻璃管的塞子,加热;
第三步:反应完成后冷却溶液,加稀HNO3酸化;
第四步:滴加过量AgNO3溶液得浅黄色沉淀;
第五步:过滤,洗涤,干燥称重得固体m克。请回答:
a.该卤代烃中所含官能团的名称是 。
b.该卤代烃的相对分子质量用含ρ、V、m的代数式可表示为 。
c.如果在第三步中加入稀HNO3的量不足,则测得相对分子质量将 (填“偏大”,“偏小”或“无影响”)。
d.写出D→乙的化学反应方程式:
(3)化合物丙中含氧为29.09%,相对分子质量不超过120,在空气中完全燃烧时,只生成CO2和H2O,经实验检测得知丙还具有下列结构和性质特点:
①核磁共振氢谱检测只有两种吸收峰,且峰面积之比1∶2;
②与FeCl3溶液作用显紫色。
写出丙与Na2CO3反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源:2013届四川省资阳市高二下学期期末考试化学试卷(解析版) 题型:实验题
(18分)透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶,制备它的一种配方中含有下列三种物质

甲 乙 丙
(1)下列试剂能与甲反应而褪色的是(填序号) 。
①溴的CCl4溶液 ②酸性KMnO4溶液 ③石蕊试液 ④含酚酞的烧碱溶液 ⑤FeCl3溶液
写出由甲在稀硫酸作用下水解的化学反应方程式:
(2)乙可以由淀粉通过下列转化制得(其中A、B、C、D均为有机物):

i.上述转化过程中涉及的条件X是 。
ii.物质A常用新制Cu(OH)2来检验,其主要的反应原理用化学方程式可表示为:
iii.上述转化过程中属于水解反应类型的有 个。
iv.D是一种液态卤代烃,已知其密度为ρ g/cm3 为测定其相对分子质量,拟实验步骤如下:
第一步:准确量取该卤代烃V mL;
第二步:在锥形瓶中加入过量的稀NaOH溶液,塞上连有长玻璃管的塞子,加热;
第三步:反应完成后冷却溶液,加稀HNO3酸化;
第四步:滴加过量AgNO3溶液得浅黄色沉淀;
第五步:过滤,洗涤,干燥称重得固体m克。请回答:
a.该卤代烃中所含官能团的名称是 。
b.该卤代烃的相对分子质量用含ρ、V、m的代数式可表示为 。
c.如果在第三步中加入稀HNO3的量不足,则测得相对分子质量将 (填“偏大”,“偏小”或“无影响”)。
d.写出D→乙的化学反应方程式:
(3)化合物丙中含氧为29.09%,相对分子质量不超过120,在空气中完全燃烧时,只生成CO2和H2O,经实验检测得知丙还具有下列结构和性质特点:
①核磁共振氢谱检测只有两种吸收峰,且峰面积之比1∶2;
②与FeCl3溶液作用显紫色。
写出丙与Na2CO3反应的化学方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com