
【题目】现有三组混合物:①CCl4 和水 ②45%的酒精水溶液 ③碘水,欲分离各组混合物,采用的主要方法依次是( )
A.溶解、过滤 、结晶B.分液、蒸馏、萃取
C.萃取、分液、蒸馏D.蒸馏、分液、萃取
科目:高中化学 来源: 题型:
【题目】E的产量是衡量一个国家石油化工水平发展的标志,F为高分子化合物,能进行如图所示的反应. 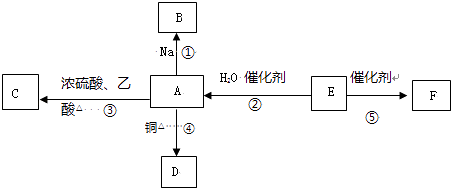
(1)请写出E的电子式 .
(2)下列反应的化学方程式:(要求有机物必须写结构简式) 反应②: 反应类型 .
反应④:反应类型 .
反应⑤:反应类型 .
(3)比较反应①剧烈程度(填>、=或<)钠和水反应的烈程度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是21世纪的新型能源.制氢的方法之一是以煤的转化为基础,部分反应如下: CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41kJmol﹣1
CaO(s)+CO2(g)CaCO3(s)△H=﹣172kJmol﹣1
CO2(g)+4H2(g)CH4(g)+2H2O(g)△H=﹣187kJmol﹣1
(1)写出CO与H2生成CH4和水蒸气的热化学方程式 .
(2)某温度下,在10L密闭容器中投入CO2、H2和CaO,仅发生CO2(g)+4H2(g)CH4(g)+2H2O(g)和CaO(s)+CO2(g)CaCO3(s)两个反应,部分物质的物质的量与时间的关系如表所示:
物质 | CO2 | H2 | CaO |
0 | 0.50 | 1.00 | 0.40 |
2 | 0.35 | 0.60 | a |
6 | 0.20 | 0.20 | b |
8 | 0.20 | 0.20 | b |
①反应在0~2min内的平均反应速率v(H2)=
②b=
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2 , CaCO3质量减小 D.充入少量CO2 , c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)CH4(g)+2H2O(g)的化学平衡常数K= . 若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为
(3)若以CH4、O2组成燃料电池,在酸性条件下负极电极反应式为.当两极消耗3.36L气体(标准状况)时,将产生的气体(假设全部逸出)通入50mL2molL﹣1 NaOH溶液中,下列说法正确的是
A.反应过程中共转移电子1.2mol
B.所得溶液为Na2CO3和NaHCO3的混合溶液
C.c(Na+ )>c(CO32﹣)>c(OH﹣ )>c(HCO3﹣)>c(H+)
D.c(OH﹣)=2c(H2CO3)+c(HCO3﹣ )+c(H+ )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】睁大眼睛看仔细,找出错的是目的。下列有关说法错误的是
A. 乙烯的结构简式为CH2=CH2.
B. 镁原子的结构示意图为
C. 氯化钠的电子式![]()
D. 甲烷的比例模型![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些朋友看一眼就喜欢了。关于图所示原电池的说法正确的是
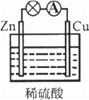
A. Cu为正极,Zn为负极
B. 电子由铜片通过导线流向锌片
C. 正极反应式为Cu-2e- = Cu2+
D. Zn发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中属于强电解质且能导电的是( )
①氢氧化钠溶液 ②硫酸钙固体 ③铜 ④蔗糖 ⑤三氧化硫 ⑥熔融氯化钠
A.①②⑤B.⑥C.③⑥D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃(含SiO2、Fe2O3、CeO2、FeO等物质)。某小组以此废玻璃为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。

己知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)废玻璃在NaOH溶液浸洗前往往要进行的操作________,反应①的离子方程式_______。
(2)反应②的离子方程武是____________。
(3)为了得到较纯的Ce3+溶液,反应②之前要进行的操作是______。
(4)反应③需要加入的试剂X可以是_________。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
![]()
用FeSO4溶液滴定用_____做指示剂,滴定终点的现象_______若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修3:物质结构与性质】
(1)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2 ,Q基态原子的外围电子(价电子)排布式为____________,
T2+的未成对电子数是______________;
(2)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
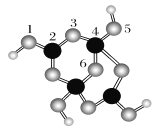
①在Xm-中,硼原子轨道的杂化类型有________;配位键存在于________原子之间(填子的数字标号);m=________(填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有______ (填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是__________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2结构相似,该晶体储 氢后的化学式应为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的的是:( )
A | B | C | D | |
实验方案 |
|
|
|
|
实验目的 | 验证FeCl3对H2O2分解反应有催化作用 | 验证单质氧化性: Cl2>Br2>I2 | 加热至混合液呈红褐色,停止加热,制备Fe(OH)3胶体 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com