
【题目】下列事实中,不能用平衡移动原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
【答案】B
【解析】
试题勒夏特列原理:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行。适用范围:所有的平衡体系。A.开启啤酒瓶后,压强减小,气体的溶解度减小,因此瓶中马上泛起大量泡沫,可以用勒夏特列原理解释,错误;B.H2+I2![]() 2HI是体积不变的可逆反应,加压后平衡不移动,碘单质的浓度增大,颜色变深,不能用勒夏特列原理解释,正确;C.饱和食盐水中含有大量的氯离子,氯气溶于水存在可逆反应:Cl2+H2OHClO+H++Cl-,相当于增加了生成物氯离子的浓度,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,可以勒夏特列原理解释,错误。D.使用过量的空气,增大氧气的浓度,平衡2SO2+O22SO3向正反应移动,可以提高二氧化硫的利用率,能用勒夏特列原理解释,错误。
2HI是体积不变的可逆反应,加压后平衡不移动,碘单质的浓度增大,颜色变深,不能用勒夏特列原理解释,正确;C.饱和食盐水中含有大量的氯离子,氯气溶于水存在可逆反应:Cl2+H2OHClO+H++Cl-,相当于增加了生成物氯离子的浓度,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,可以勒夏特列原理解释,错误。D.使用过量的空气,增大氧气的浓度,平衡2SO2+O22SO3向正反应移动,可以提高二氧化硫的利用率,能用勒夏特列原理解释,错误。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。

(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是________;发生装置B应选择以下三种装置中的________(选填序号)。

(2)D装置中主要反应的离子方程式为_______________________
(3)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液 ⑤酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,再加入________(选填一个序号)试剂。发生的现象是______________。若SO2过量,取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,发生的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。
(1)硒常用作光敏材料,基态硒原子的价电子排布图为__________;与硒同周期的p区元素中第一电离能大于硒的元素有__________种;SeO3的空间构型是_______________。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu—Ni—Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________________________________。
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2。(SCN)2分子中硫原子的杂化方式是__________________,σ键和π键数目之比为_____________。
(4)Co(NH3)5Cl3是钴的一种配合物,向100mL0.2mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀,则该配合物的化学式为_____________,中心离子的配位数为________________。
(5)已知:r(Fe2+)为61pm,r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是__________________________________。
(6)某离子型铁的氧化物晶胞如下图所示,它由X、Y组成,则该氧化物的化学式为________________________。已知该晶体的密度为dg·cm-3,阿伏加德罗常数的值为NA,则该品体的晶胞参数a=_______pm(用含d和NA的代数式表示)。
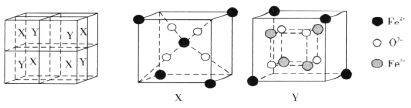
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J mol-1·K-1,该反应能自发进行的温度范围为____。
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J mol-1·K-1,该反应能自发进行的温度范围为____。
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。

①工业生产时一般会选用P4和1250℃进行合成,请解释其原因___________。
②在压强为P3、1000℃的条件下,该反应5min时达到平衡点Y,则用CO表示该反应的速率为_____,该温度下,反应的平衡常数为_________(保留3位有效数字)。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) ![]() CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是________。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.混合气体中H2O的百分含量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向__________(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中错误的是

A. 此过程中铁被腐蚀
B. 此过程中电子从Fe移向Cu
C. 正极电极反应式为:2H++2e-===H2↑
D. 此过程中还涉及反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
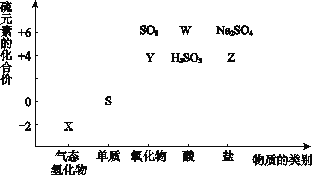
(1)Y的化学式为_________,检验Y所用的试剂是________________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______(填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4d.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据是
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 | |
实 验 方 案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡, 试管中出现浑浊 | 测得ΔH为ΔH1、ΔH2的和 | H2与O2的体积比约为2︰1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 电子由低能级跃迁至较高能级时,可通过光谱仪直接摄取原子的发射光谱
B. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
C. NH3和CH4的中心原子都是sp3杂化
D. SO2和CO2都是直线形分子,其中心原子都是sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol·Lˉ1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是( )

A. HX为弱酸
B. M点c(HX)—c(X-)﹥c(OH-)—c(H+)
C. 将P点和N点的溶液混合,呈酸性
D. 向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX)=c(Cl-) >c(X-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com