
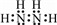 .
. ,N采用sp3杂化方式,粒子空间构型为V形.
,N采用sp3杂化方式,粒子空间构型为V形. 分析 (1)该氮氢化合物中N(H)=$\frac{32×12.5%}{1}$=4,故分子中N(N)=$\frac{32-4}{14}$=2,该氮氢化合物为N2H4,分子中氢原子之间形成1对共用电子对,氢原子与氮原子之间形成1对共用电子对;
(2)N2H4与液态双氧水恰好完全反应,产生两种无毒又不污染环境的物质,则生成氮气与水;
(3)N2H4分子中每个N原子都含有1对孤对电子,故1molN2H4与2molHCl反应生成N2H6Cl2;
(4)①N2H62+中N的化合价为+4价,N2H62+是由中性分子 N2H4 结合2个质子形成的,相当于故N2H62+相当于二元酸,碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O;
②NH2-的电子式为: ;结构中原子杂化轨道和甲烷结构类似,据此分析.
;结构中原子杂化轨道和甲烷结构类似,据此分析.
解答 解:(1)该氮氢化合物中N(H)=$\frac{32×12.5%}{1}$=4,故分子中N(N)=$\frac{32-4}{14}$=2,该氮氢化合物为N2H4,分子中氢原子之间形成1对共用电子对,氢原子与氮原子之间形成1对共用电子对,其电子式为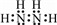 ,
,
故答案为: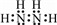 ;
;
(2)N2H4与液态双氧水恰好完全反应,产生两种无毒又不污染环境的物质,则生成氮气与水,该反应化学方程式为:N2H4+2H2O2=N2+4H2O,
故答案为:N2H4+2H2O2=N2+4H2O;
(3)N2H4分子中每个N原子都含有1对孤对电子,故1molN2H4与2molHCl反应生成N2H6Cl2,反应方程式为N2H4+2HCl=N2H6Cl2,
故答案为:N2H4+2HCl=N2H6Cl2;
(4)①N2H62+中N的化合价为+4价,N2H62+是由中性分子N2H4结合2个质子形成的,故N2H62+相当于二元酸,故在碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O,故答案为:N2H62++2OH-=N2H4+2H2O;
②NH2-的电子式为 ,结构中原子杂化轨道和甲烷结构类似,N原子采取sp3杂化,粒子空间构型为V型,
,结构中原子杂化轨道和甲烷结构类似,N原子采取sp3杂化,粒子空间构型为V型,
故答案为: ;sp3;V型.
;sp3;V型.
点评 本题考查较为综合,涉及物质的结构、电子式,侧重于考查综合运用化学知识的能力,题目难度中等,注意把握题给信息.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| B. | Na2CO3 NaHCO3 NH4Cl NaCl | |
| C. | (NH4)2SO4 NH4Cl NaNO3 Na2S | |
| D. | NH4Cl (NH4)2SO4 Na2S NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由A、C两种元素的原子可形成10电子的分子 | |
| B. | F与D形成的稳定化合物能用来制作信息材料,不与任何酸反应 | |
| C. | 原子半径的大小顺序:r(E)>r(F)>r(D)>r(C) | |
| D. | 某些元素气态氢化物稳定性由强到弱的顺序:D>C>F>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
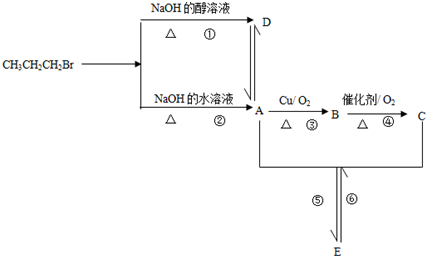
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 101 mL | B. | 100 mL | C. | 200 mL | D. | 120 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com