
【题目】A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)E在周期表中的位置为____________________;B2F4的电子式_________________。
(2)B的最高价氧化物的水化物与其氢化物反应生成Z,则Z的名称为_______________,Z的化学键类型为____________________。
(3)可以比较C和E得电子能力强弱的是___________________(填写编号) 。
a.比较这两种元素最高正价的大小
b.二者形成的化合物中,D 元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(4)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为_____________________________________。
【答案】 第三周期第ⅥA族 电子式: 硝酸铵 离子键、共价键 b.c HSO3- +H+ = H2O+SO2 ↑
硝酸铵 离子键、共价键 b.c HSO3- +H+ = H2O+SO2 ↑
【解析】本题元素周期表和元素周期律的应用,F元素的原子在周期表中半径最小,即F为X,常见的化合物D2C2与水反应生成C的单质,且溶液显碱性,则D2C2为Na2O2,C为O,D为Na,C和E同主族,则E为S,A与C最外层电子数之比为2:3,则A的最外层电子数为4,因为A与B相邻,B与C相邻,因此A为C,B为N,(1)E为S,位于第三周期VIA族;化学式为N2H4,其电子式为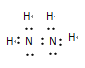 ;(2)N的最高价氧化物的水化物是HNO3、氢化物为NH3,两者反应生成NH4NO3,名称为硝酸铵;硝酸铵属于离子化合物,含有离子键和(极性)共价键;(3)a、比较非金属性的强弱或得电子能力,与元素的最高正价大小无关,故a错误;b、形成的化合物,得电子能力强的电子对偏向谁,化合价显负价,故选项b正确;c、得电子能力越强,非金属性越强,其氢化物的稳定性越强,因此通过两种元素的氢化物的稳定性,判断得电子能力,故c正确;(4)这两种化合物是NaHSO4和NaHSO3,因此反应的离子方程式为HSO3-+H+=SO2↑+H2O。
;(2)N的最高价氧化物的水化物是HNO3、氢化物为NH3,两者反应生成NH4NO3,名称为硝酸铵;硝酸铵属于离子化合物,含有离子键和(极性)共价键;(3)a、比较非金属性的强弱或得电子能力,与元素的最高正价大小无关,故a错误;b、形成的化合物,得电子能力强的电子对偏向谁,化合价显负价,故选项b正确;c、得电子能力越强,非金属性越强,其氢化物的稳定性越强,因此通过两种元素的氢化物的稳定性,判断得电子能力,故c正确;(4)这两种化合物是NaHSO4和NaHSO3,因此反应的离子方程式为HSO3-+H+=SO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】铝电池性能优越,Al-Ag2O2电池用于电解尿素[CO(NH2)2]的碱性溶液制备氢气(隔膜Ⅱ仅阻止气体通过,a、b均为惰性电极).下列说法正确的是
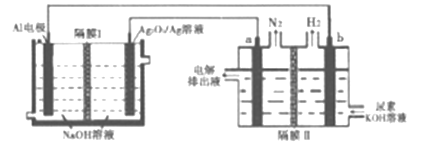
A. Ag电极是正极,反应后该电极区溶液pH减小
B. 原电池的总反应为:2Al+3Ag2O2+2NaOH=2NaAlO2+3Ag2O+H2O
C. a电极上的电极反应为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
D. 每消耗2.7g铝,理论上a、b两极共产生气体3.36L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,硫化铜矿的湿法冶炼技术已经取得了很大的发展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:

反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图~如图所示)。

回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
②2Cu2S+3O2![]() 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S![]() 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
(2)写出反应1的化学方程式:________________。经查,硫黄、FeSO4·7H2O均可入药,用途广泛,湿法炼铜与火法炼铜相比,优点是_____________________。
(3)从溶液中得到FeSO4·7H2O晶体的操作是_______________________________。
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为________(填字母代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在元素周期表中处于A,B位置的某些元素性质相似,这称为“对角线规则”.下列有关4号元素铍的性质的推断正确的是( )
A | |
B |
A.铍能与冷水发生剧烈反应
B.氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应
C.氢氧化铍的化学式为Be(OH)3
D.氧化铍只溶于强酸溶液,不溶于强碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)在 ①液氯 ② ③白磷 ④氯气
③白磷 ④氯气
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧红磷
⑧红磷
这八种物质中,互为同分异构体的是____,互为同素异形体的是_____。(填序号)
(2)在下列固体中:①CaCl2 ②KOH ③He ④H2SO4 ⑤NH4Cl ⑥金刚石
①其中不含化学键的晶体是_________,
②既含有离子键又含有共价键的物质是______,
③固体熔化时只需破坏共价键的晶体是____(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A. 简单离子半径:W<X<Z B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示。下列说法正确的是
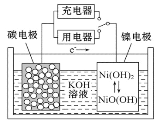
A.充电时,阴极的电极反应为:Ni(OH)2+OH--e-===NiO(OH)+H2O
B.放电时,负极的电极反应为:H2-2e-+2OH-=== 2H2O
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com