
【题目】下列实验装置能达到实验目的有几个装置( ) 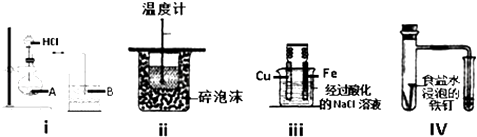
①在装置i的烧瓶A中装入饱和碳酸钠溶液,在烧杯B中装入水玻璃(硅酸钠溶液),可以证明非金属性:Cl>C>Si
②在装置i的烧瓶A中装入饱和碳酸钠溶液,在烧杯B中装入水玻璃(硅酸钠溶液),可以证明酸性:HCl>H2CO3>H2SiO3
③装置ii可以测定酸碱中和热
④装置iii在保护金属Fe,是牺牲阳极的阴极保护法
⑤装置IV可验证铁的吸氧腐蚀实验.
A.1个
B.2个
C.3个
D.全部
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述 ,正确的一项是( )
A. 含有共价键的化合物一定是共价化合物
B. 单质分子中均不存在化学键
C. 含有分子间作用力的分子一定含有共价键
D. 离子化合物中一定含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用烧热的钢针去接触涂有薄薄一层石蜡的云母片的反面,熔化了的石蜡呈椭圆形,这是因为( )。
A.云母是热的不良导体,传热不均匀
B.石蜡是热的不良导体,传热不均匀
C.石蜡具有各向异性,不同方向导热性能不同
D.云母具有各向异性,不同方向导热性能不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知15P、33As位于同一主族.下列关系正确的是( )
A. 原子半径:As>Cl>P B. 非金属性:Cl>S>As
C. 热稳定性:HCl>AsH3>PH3 D. 酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)在工业上具有非常广泛的应用。某化学兴趣小组用镁与氮气反应制备Mg3N2并进行有关实验。实验装置如下所示:
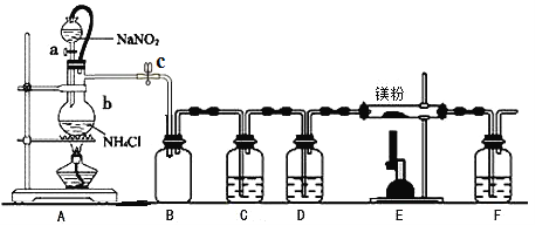
已知:①氮化镁常温下为浅黄色粉末,极易与水反应。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
回答下列问题:
(1)仪器b的名称是________,写出装置A中发生反应的化学方程式___________________。
(2)某同学检验装置A部分的气密性,关闭止水夹c后,开启活塞a,水不断往下滴,直至全部流入烧瓶。试判断:A部分装置是否漏气?________(填“漏气”、“不漏气”或“无法确定”),判断理由:____________。
(3)装置C中为饱和硫酸亚铁溶液,作用是___________,F装置的作用是_______________________。
(4)加热至反应开始发生,需移走A处酒精灯,原因是_______________________________________。
(5)反应结束后,取m g E中样品于试管中,加足量蒸馏水,得V mL气体(换算为标准状况),则样品中氮化镁的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2molL﹣1 , 溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( ) 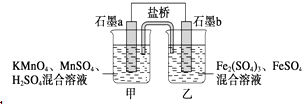
A.电池工作时,盐桥中的SO42﹣移向乙烧杯
B.石墨b的电极反应式为Fe2+﹣e﹣═Fe3+
C.当有0.1 mol SO42﹣进入烧杯时,反应消耗H+0.2 mol
D.当 MnSO4浓度变为2.2 molL﹣1时,反应中转移电子0.2 mol(不考虑溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等,回答下列问题:
(1)铅与碳是同族元素,则下列说法正确的是 .
a.主要化合价为+2,+4
b.同族的Si与Ge(锗)均为半导体材料,铅也为半导体材料.
c.铅的最高价氧化物对应水化物的酸性强于碳酸
d.与同族的Ge(锗)作比较:碱性Ge(OH)4<Pb(OH)4 , 则金属性Ge<Pb,周期表中位置Pb在Ge下面.
e.同族的Ge(锗)与盐酸不反应,Pb与盐酸能反应,则原子半径Ge>Pb
(2)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 .
(3)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)△H=a kJmol﹣1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)△H=b kJmol﹣1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)△H=c kJmol﹣1
反应3PbS(s)+6O2(g)=3PbSO4(s)△H=kJmol﹣1(用含a,b,c的代数式表示).
(4)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图1所示,该电池正极的电极反应式为 . 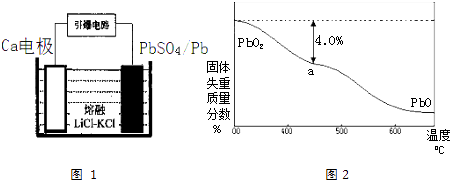
(5)PbO2在加热过程发生分解的失重曲线如图2所示,已知失重曲线上的a点为样品失重4.0%[即:( ![]() ×100%]的残留固体.若a点固体组成表示为PbOx或mPbO2nPbO,列式计算x值 , 和m:n值 .
×100%]的残留固体.若a点固体组成表示为PbOx或mPbO2nPbO,列式计算x值 , 和m:n值 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池
B.氢氧化铝可用于中和过多胃酸
C.绿色化学要求从源头上消除或减少生产活动对环境的污染
D.泡沫灭火器可用于一般的起火,也适用于电器起火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化钠固体易吸收空气中的二氧化碳而变质。取4.65 g已部分变质的氢氧化钠固体与36.5 g 10%的盐酸恰好完全反应后,将溶液蒸干,所得固体的质量是( )
A. 11.7 g B. 5.85 g C. 4.65 g D. 8.3 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com