
二氧化铈![]() 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含![]() 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
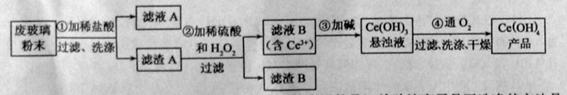
(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗涤的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的![]()
![]() 产品0.536g,加硫酸溶解后,用0.1000mol•
产品0.536g,加硫酸溶解后,用0.1000mol•![]() 标准溶液滴定终点是(铈被还原为
标准溶液滴定终点是(铈被还原为![]() ),消耗25.00mL标准溶液,该产品中
),消耗25.00mL标准溶液,该产品中![]() 的质量分数为 。
的质量分数为 。
(1)滤渣上附着的Fe3+、Cl-,取最后洗涤液少量,滴加AgNO3,如无白色沉淀,则洗干净。
(2)2CeO2+H2O2+6H+=2Ce3++O2 ![]() +4 H2O SiO2
+4 H2O SiO2
(3)不能 分液漏斗
(4)97.01%
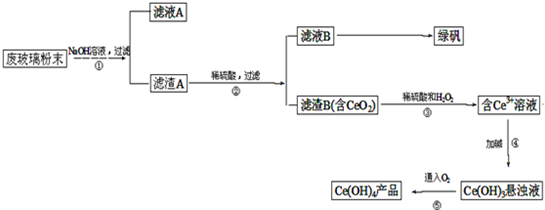
【解析】该反应过程为:①CeO2、SiO2、Fe2O3等中加入稀盐酸,、Fe2O3转化FeCl3为存在于滤液中,滤渣为CeO2和SiO2②加入稀硫酸和H2O2,CeO2转化为Ce3+滤渣为SiO2③加入碱后Ce3+转化为沉淀,④通入氧气讲Ce从+3氧化为+4,得到产品。
Ce(OH)4~ FeSO4
n(Ce(OH)4)= n(FeSO4)=0.1000mol/L*1.025L=0.0025mol,m=0.0025mol*208g/mol=0.52g
【考点定位】以工艺流程为基础,考察化学实验基本操作、元素及化合物知识、化学计算、氧化还原反应等相关知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省唐河县第一高级中学高一下第四次月考化学试卷(带解析) 题型:实验题
二氧化铈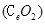 是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含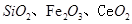 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: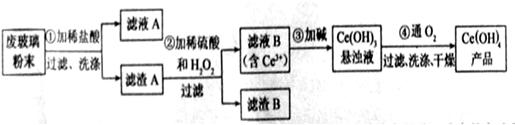
(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗净的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
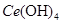 产品0.536g,加硫酸溶解后,用0.1000mol?
产品0.536g,加硫酸溶解后,用0.1000mol?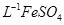 溶液(铈被还原为
溶液(铈被还原为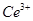 ),消耗25.00mL溶液,该产品中
),消耗25.00mL溶液,该产品中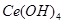 的质量分数为 。
的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2015届河南省高一下第四次月考化学试卷(解析版) 题型:实验题
二氧化铈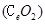 是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含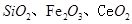 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
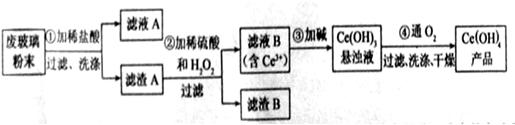
(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗净的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
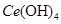 产品0.536g,加硫酸溶解后,用0.1000mol?
产品0.536g,加硫酸溶解后,用0.1000mol?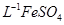 溶液(铈被还原为
溶液(铈被还原为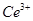 ),消耗25.00mL溶液,该产品中
),消耗25.00mL溶液,该产品中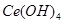 的质量分数为 。
的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com