
【题目】新冠病毒由蛋白质外壳和单链核酸组成,直径大约在60~140nm,怕酒精,不耐高温。下列说法正确的是
A.病毒由碳、氢、氧三种元素组成
B.新冠病毒扩散到空气中不可能形成胶体
C.医用酒精能用于消毒是因为它有强氧化性
D.高温可使蛋白质发生变性
科目:高中化学 来源: 题型:
【题目】t℃时,将2mol气体A和1mol气体B充入容积为2L的恒容密闭容器中,发生如下反应:2A(g)+B(g)xC(g),2min时化学反应达到限度(温度仍为t℃),此时B还有 0.6mol,并测得C的浓度为0.6molL﹣1 . 请回答下列问题:
(1)判断该反应达到限度的标志是 a.容器中的压强保持不变
b.A的生成速率与B的消耗速率之比为2:1
c.容器内混合气体的密度保持不变
d.A的百分含量保持不变
e.B和C的物质的量浓度之比为1:x
(2)x= , 从反应开始到达到限度时,用B表示该反应的平均反应速率V(B)=;
(3)若保持温度不变,增大容器体积,则正反应速率(填“增大”、“减小”或“不变”)
(4)化学反应达到限度时,A的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
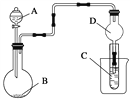
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来验证元素周期律. 用过氧化氢的水溶液和二氧化锰制备氧气,并将其通入到氢硫酸(H2S的水溶液)中.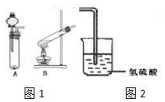
(1)过氧化氢的电子式:;
(2)从图1中选择氧气的制备装置 , 反应前需要的操作是:;
(3)该实验如何证明O的非金属性强于S(用化学方程式表示);
(4)你认为能证明Cl的非金属性强于S的是 a.S在常温下为固体而Cl2为气体 b.H2S不如HCl稳定
c.H2SO3的酸性弱于HClO3 d.S与H2化合不如Cl2与H2化合剧烈.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯可用下图所示装置。请回答下列问题

(1)关闭G夹,打开B夹,从装有少量苯的三颈烧瓶的A口加少量溴,再加入少量铁屑,塞住A口,三颈烧瓶中发生的主要反应的化学方程式为_________________________________。
(2)试管C中苯的作用是:____________________。试管D中出现的现象是:_____________。试管E中出现的现象是:___________________。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开G夹,关闭B夹,可以看到的现象是_______________ 。
(4)三颈烧瓶中的溴苯经过下列步骤分离提纯:
①向三颈烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是__________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______。
④经过上述分离操作后,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为: 。
(2)装置B中饱和食盐水的作用是;
同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是。该现象(填“能”或“不能”)说明溴的非金属性强于碘,原因是。
(5)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:。
请判断改用NaHSO3溶液是否可行?(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的说法不正确的是( )
A. 合金的熔点一般比它的成分金属的熔点高
B. 合金的硬度一般比它的成分金属大
C. 合金与各成分金属相比,具有许多优良的物理、化学或机械的性能
D. 合金在工业上的用途比纯金属更广
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com