
已知t℃时,纯水中[H+]=2×10-7 mol·L-1,在该温度下Mg(OH)2的溶度积Ksp[Mg(OH)2]=3.2×10-11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为多少?
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
已知t℃时,纯水中[H+]=2×10-7 mol·L-1,在该温度下Mg(OH)2的溶度积Ksp[Mg(OH)2]=3.2×10-11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为多少?
查看答案和解析>>
科目:高中化学 来源:2011-2012学年天津市蓟县一中高二第三次月考化学试卷(带解析) 题型:填空题
(8分)现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵⑤硫酸铝 ⑥碳酸氢钠。请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)。
(2)已知T℃,纯水中c(H+)=1×10-6.5 mol·L-1,则T℃ (填“>”、“<”、“=”)25℃。在T℃时,将pH = 11的③溶液a L与pH = 1的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b = 。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是 ,产生该现象的原因是 (用离子方程式解释原因)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省龙岩一中高二第四学段模块考试化学试卷 题型:填空题
(11分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下: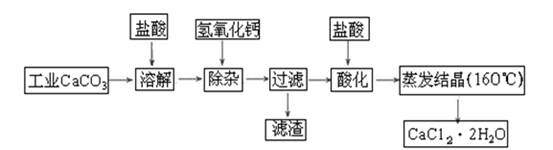 (1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
(1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
________________________________________________________________________;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③___________________________;
(3)测定样品中Cl-含量的方法是:
a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.00 mL。
①上述测定过程中需用溶液润洗的仪器有__________________ ______________,
______________,
②计算上述样品中CaCl2·2H2O的质量分数为________________;
(4)已知t℃时,纯水中c(H+)=2×10-7 mol·L-1,在该温度下Mg(OH)2的溶度积[Ksp[Mg(OH)2]=3.2×10- 11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
查看答案和解析>>
科目:高中化学 来源:2013届天津市高二第三次月考化学试卷(解析版) 题型:填空题
(8分)现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵⑤硫酸铝 ⑥碳酸氢钠。请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)。
(2)已知T℃,纯水中c(H+)=1×10-6.5 mol·L-1,则T℃ (填“>”、“<”、“=”)25℃。在T℃时,将pH = 11的③溶液a L与pH = 1的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b = 。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是 ,产生该现象的原因是 (用离子方程式解释原因)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com