
| A. | 碘-131的中子数为78 | B. | 碘-131的质量数为53 | ||
| C. | 碘与铯互称同位素 | D. | 铯-137的质子数为137 |
科目:高中化学 来源: 题型:选择题

| A. | 由CuFeS2生成Cu2S,SO2和铁的氧化物反应中硫元素被还原 | |
| B. | 熔炼过程中的主要反应为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | |
| C. | 铜的电解精炼过程中纯铜做阳极 | |
| D. | 上述冶炼过程产生大量SO2,通常用饱和NaHSO3溶液吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
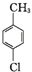 +2Cl2$\stackrel{hv}{→}$
+2Cl2$\stackrel{hv}{→}$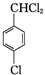 +2HCl,该反应过程中涉及的反应类型是取代反应.
+2HCl,该反应过程中涉及的反应类型是取代反应.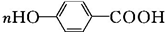 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$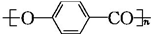 +nH2O.
+nH2O. ,D与银氨溶液发生反应的化学方程式为
,D与银氨溶液发生反应的化学方程式为 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$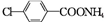 +H2O+2Ag↓+3NH3.
+H2O+2Ag↓+3NH3.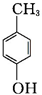 为原料制备G(
为原料制备G(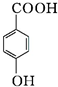 )的合成路线:
)的合成路线: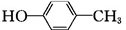 $\stackrel{CH_{3}I}{→}$
$\stackrel{CH_{3}I}{→}$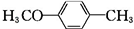 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$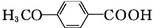 $\stackrel{HI}{→}$
$\stackrel{HI}{→}$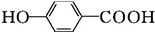 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳酸氢钠治疗胃酸过多 | |
| B. | 用双氧水给伤口清洗和消毒 | |
| C. | 用盐酸除去铁锈 | |
| D. | 用溶有碘化钾的淀粉试纸检验某装置是否漏出氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3 | B. | HCO3- | C. | NH4+ | D. | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷分子的比例模型: | B. | 聚丙烯的结构简式: | ||
| C. | 乙酸的实验式为:CH2O | D. | 化学名词:乙酸乙脂、苯、钳锅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com