
【题目】下列变化需要加入氧化剂才能实现的是( )
A. NaOH→NaCl B. H2SO4→H2 C. HCl→Cl2 D. CaCO3→CO2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示.下列说法中,正确的是( ) 
A.W的最高价氧化物对应的水化物是强酸
B.Y的原子半径在同周期主族元素中最大
C.W的非金属性比Z的弱
D.Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL浓度为2mol/L的NaOH溶液.选用容量瓶的规格和所需NaOH的质量分别为( )
A.100 mL 容量瓶、40 g
B.500 mL 容量瓶、40 g
C.100 mL 容量瓶、80 g
D.500 mL 容量瓶、80 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
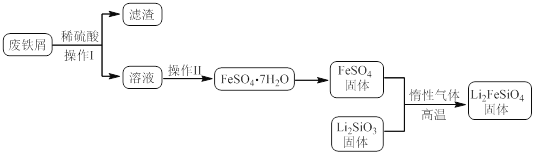
实验(二) Li2FeSiO4含量测定:
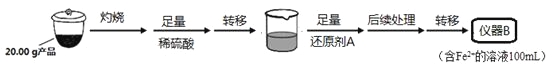
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系正确的是
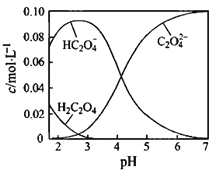
A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B. c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-)
C. c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-)
D. pH=7的溶液中:c(Na+)=2c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,其学名、俗名及化学式不相符合的是( )
A. 碳酸钠、纯碱、Na2CO3 B. 碳酸氢钠、小苏打、NaHCO3
C. 氢氧化钠、火碱、NaOH D. 碳酸钙、生石灰、CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活和生产中应用广泛。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g) ![]() H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)
H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1) ![]() H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)
H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) ![]() H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
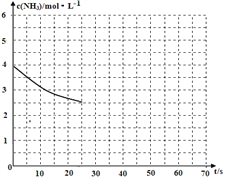
② 若保持温度和容器体积不变,向平衡体系中再通入2molNH3和2molH2O,此时v正______v逆(填“>”、“=”或“<”)
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业 生产NaN3主要是在175℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式_______________________。
(4)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。镁海水电池可为灯塔提供能源,其装置如图所示。下列有关镁海水电池的说法正确的是
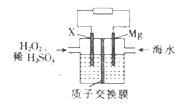
A. Mg电极上发生还原反应
B. 该电池工作一段时间后,左侧溶液质量减轻
C. 正极的电极反应式为H2O2+2e-+2H+=2H2O
D. 若电池工作时转移2 mol电子,则有2 mol H+由质子交换膜左侧向右侧迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com