
SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质
A.立刻褪色 B.慢慢褪色
C.颜色不褪 D.先褪色,后复原
科目:高中化学 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
用石墨电极电解500mLNaNO3和Cu(NO3)2的混合溶液。通电一段时间后,阴、阳两极逸出的气体在标准状况下的体积分别为11.2L和8.4L,求原溶液中Cu2+的物质的量浓度(假设溶液的体积不变):
A.1.25 mol?L-1 B.2.5 mol?L-1
C.0.50 mol?L-1 D.1.0 mol?L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(文)试卷(解析版) 题型:选择题
打雷放电时,空气中有少量氧气会转化成臭氧(3O2=2O3),使空气变得更加清新。下列有关说法中正确的是
A.该变化是物理变化 B.O2与O3都是单质
C.O2与O3是相同的物质 D.O2与O3的性质完全一样
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(文)试卷(解析版) 题型:选择题
硬水和软水的本质区别是
A.硬水浑浊、软水澄清
B.硬水含有杂质、软水含杂质少
C.硬水是不纯净水,软水是纯净水
D.硬水含有较多可溶性钙镁化合物、软水不含或含少量可溶性钙镁化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:填空题
(10分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是 。不采用铜跟浓硫酸反应来制取硫酸铜的原因是
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
(4)将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
科学的假设与猜想是科学探究的先导和价值所在。在下列假设或猜想引导下的探究肯定没有意义的是
A.探究SO2和Na2O2反应可能有Na2SO4生成
B.探究NO和N2O可能化合生成NO2
C.探究NO2可能被NaOH溶液完全吸收生成NaNO2、NaNO3和H2O
D.探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的原因是溶液的酸碱性改变还是HClO的漂白作用
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
在两个容积相同的密闭容器中,一个盛有NO气体,另一个盛有N2和O2的混合气体。在同温同压下,两容器内的气体一定具有相同的
A.原子数 B.密度 C.质量 D.质子数
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:填空题
(10分)氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。常用电离常数Kb和电离度α来定量表示氨水的电离程度,它们均可通过各浓度氨水对应的c(OH-)进行换算。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1 氨水
【实验数据】(不必填表格)
烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O) (mol·L-1) | c(OH-) | Kb | α |
1 | 50.00 | 0.00 | 1.34×10-3 | |||
2 | 25.00 | 25.00 | 9.48×10-4 | |||
3 | 5.00 | 45.00 | 4.24×10-4 |
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb 。
。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1
的NaOH溶液和20.00mL0.10mol·L—1氨水所得的滴定曲线如图。
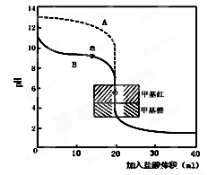
请指出盐酸滴定氨水的曲线为 (填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2= 2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:选择题
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的CuO粉末 B.将锌粒投入CuSO4溶液
C.CO2通过Na2O2粉末 D.将铜片投入FeCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com